
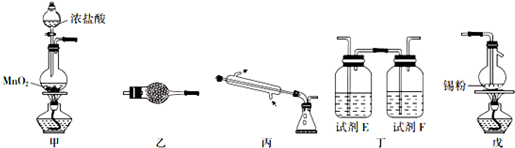
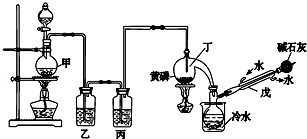
分析 SnCl4极易水解,反应应在无水环境下进行进行,甲中发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+Cl2↑+2H2O,由于盐酸易挥发,制备的氯气中含有HCl及水蒸气,丁中试剂E为饱和食盐水除去HCl,可以降低氯气的溶解,试剂F为浓硫酸吸收水蒸气,干燥氯气,氯气与Sn在装置戊中反应生成SnCl4,未反应的氯气,用装置乙中的碱石灰吸收,同时碱石灰还可以防止空气中水分进入装置戊使产物水解,以此解答该题.
解答 解:(1)根据装置图可知,装置甲中反应容器的名称是圆底烧瓶,试剂E和F分别是饱和食盐水、浓硫酸,
故答案为:圆底烧瓶;饱和食盐水;浓硫酸;
(2)装置甲中发生反应的化学方程式为 MnO2+4HCl(浓 $\frac{\underline{\;\;△\;\;}}{\;}$MnC12+Cl2↑+2H2O,装置戊中发生反应的化学方程式为Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnC12+Cl2↑+2H2O;Sn+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SnCl4;
(3)该实验中先制备氯气,氯气经丁装置除杂,干燥后与锡在装置戊中反应生成SnCl4,尾气用乙装置吸收,所以连接顺序是甲→丁→戊→乙,实验开始时先要用氯气将装置中空气排尽,防止空气中的水分对产物的影响,所以先点燃甲处的酒精灯,
故答案为:丁;戊;乙;甲;
(4)装置乙的作用是 吸收未反应的氯气同时防止空气中水分进入装置戊使产物水解,
故答案为:吸收未反应的氯气同时防止空气中水分进入装置戊使产物水解;
(5)四氯化锡熔点-33℃,沸点114,1℃,所以提纯SnCI4的方法是蒸馏,故选d;
(6)四氯化锡与空气中水分反应生成白烟H2SnO4和氯化氢,反应方程式为SnCl4+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$H4SnO4↓+4HCl,
故答案为:SnCl4+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$H4SnO4↓+4HCl.
点评 本题考查制备实验方案设计、对原理与装置的分析评价、物质检验方案设计等,注意阅读题目获取信息并迁移运用,难度中等.


科目:高中化学 来源: 题型:解答题
| 分子式 | 相对分子 质量 | 熔点 /℃ | 沸点 /℃ | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | |||||
| CH3COOH | 60 | 16.6 | 117.9 | 1.05 | 互溶 | 互溶 | 互溶 |
| C2H5OH | 46 | -117.3 | 78.5 | 0.8 | 互溶 | / | 互溶 |
| CH3COOC2H5 | 88 | -83.58 | 77.1 | 0.9 | 可溶 | 互溶 | 互溶 |
| C2H5OC2H5 | 74 | -116.2 | 34.51 | 0.7 | 可溶 | 互溶 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
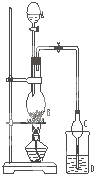 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol (燃烧热) | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | S(s)+O2(g)═SO2(g)△H=-296.8 kJ/mol (反应热) | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质发生化学变化不一定伴随着能量变化 | |
| B. | 硫酸钡、醋酸铵、氨水都是弱电解质 | |
| C. | 向0.1 mol•L-1 Na2CO3溶液中滴加酚酞,溶液变红色 | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3△H1+2△H2-△H3 | B. | △H1+△H2-△H3 | C. | 3△H1+△H2+△H3 | D. | 3△H1+△H2-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com