
| A、Na+、Ag+、CO32-、Cl- |
| B、NH4+、Na+、SO42-、ClO- |
| C、K+、Al3+、NO3-、SO42- |
| D、Na+、Fe3+、NO3-、I- |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| 粒子代码 | a | e | H |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
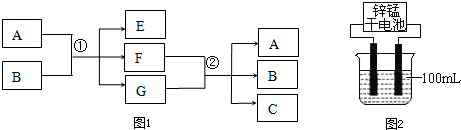
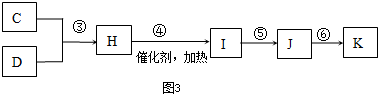
查看答案和解析>>
科目:高中化学 来源: 题型:
A、水解反应是典型的可逆反应,水解反应的化学平衡常数称为水解常数(用Kh表示),Na2CO3第一步水解反应的水解常数的表示式 Kh≤
| ||||||
| B、HS-电离的离子方程式:HS-+H2O?H3O++S2- | ||||||
| C、N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率变小 | ||||||
D、CO(g)的燃烧热是283.0kJ?mol-1,则表示CO(g)的燃烧热的热化学方程式为:CO(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1H2S溶液:c(H+)>c(OH-) |
| B、0.1 mol?L-1 NH4Cl溶液:c(H+)=c(OH-) |
| C、在0.1 mol?L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+) |
| D、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将NaHY晶体加入水中一定能促进水的电离 |
| B、若NaHY的水溶液显碱性,该溶液中粒子浓度关系为:c (Na+)>c (OH-)>c (H+)>c (HY-) |
| C、若溶液中c(H+)+c(H2Y)=c(OH-)+c(Y2-),则NaHY的水溶液一定显碱性 |
| D、若NaHY溶液的pH=4,该溶液中粒子浓度关系为:c (Na+)>c (HY-)>c (H+)>c (Y2-)>c (H2Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①③ | C、②③ | D、①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | A | B | C | D |
| 实验 方案 |
 食盐水 |
 片刻后在Fe电极附近滴入K3[Fe(CN)6]溶液 |
 |
 置于光亮处 |
| 实验 目的 |
验证铁钉发生 析氢腐蚀 |
验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 化学反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验Ⅰ:振荡后静置,上层溶液颜色保持不变 |
| B、实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 |
| C、实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时不可能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com