
分析 物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,
①锌与醋酸反应生成醋酸锌和氢气;
②若Zn不足量,酸有剩余,相同浓度的醋酸和盐酸中,反应过程中醋酸中氢离子浓度小于盐酸,氢离子浓度越大,反应速率越大,反应时间越短;
③若Zn过量,产生H2的量与酸的物质的量成正比.
解答 解:物质的量浓度相等的盐酸和醋酸,醋酸中氢离子浓度小于盐酸,
①锌与醋酸反应生成醋酸锌和氢气,离子方程式:Zn+2CH3COOH=Zn2++2CH3COO-+H2↑;
故答案为:Zn+2CH3COOH=Zn2++2CH3COO-+H2↑;
②若Zn不足量,酸有剩余,相同浓度的醋酸和盐酸中,盐酸中氢离子浓度大于醋酸,所以盐酸反应速率大于醋酸,
故答案为:>;
③若Zn过量,产生H2的量与酸的物质的量成正比,醋酸和盐酸都是一元酸,且体积、浓度相等,则其物质的量硝酸,所以生成氢气的物质的量相等,
故答案为:=.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,知道反应速率与离子浓度成正比、与电解质强弱无关,为易错点.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | Na和O2 | B. | NaOH溶液和CO2 | ||
| C. | Na2O2和CO2 | D. | NaOH溶液和Ca(HCO3)2溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
短周期元素A、B、C、D、E原子序数依次增大。已知元素A的气态氢化物和A的最高价氧化物对应的水化物反应生成盐;B、E为同主族元素,B元素原子最外层电子数是次外层的3倍;D是地壳中含量最多的金属元素;C是短周期中与水反应最激烈的金属元素。下列叙述不正确的是
A. 元素A的氧化物常温下一般均为无色无味气体
B. 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应
C. 原子半径:C>D>B
D. 元素B的气态氢化物的沸点比元素E气态氢化物的沸点高
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省徐州市高一上第一次月考化学卷(解析版) 题型:选择题
下列化合物中属于共价化合物的是
A.NaCl B.NaOH C.CH4 D.(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是光纤制品的基本原料 | |
| B. | 水玻璃可用于生产黏合剂和防火剂 | |
| C. | 硅元素在自然界中既有游离态也有化合态 | |
| D. | 硅是将太阳能转化为电能的常用材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入CH4的电极为负极 | |
| B. | 负极发生氧化反应 | |
| C. | 该电池使用一段时间后无需补充KOH | |
| D. | 燃料电池工作时,溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 高空中臭氧层能够吸收太阳紫外线,为地球上的生物提供了天然的保护屏障,但低空的臭氧浓度过大,会给生物造成伤害 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 用K2FeO4代替Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,还有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
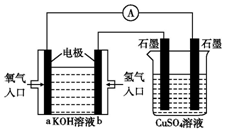 可用碱性氢氧燃料电池组装如图所示的装置:
可用碱性氢氧燃料电池组装如图所示的装置:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com