
【题目】已知HF 和HCN 都是一元弱酸,但Ka(HF)>Ka(HCN)。现有100mL0.1mol/L 的NaF 溶液(代号“甲”)和100mL 0.1mol/L 的NaCN 溶液(代号“乙”),下列有关甲、乙两种溶液的说法中不正确的是( )
A. 溶液pH:甲<乙 B. 溶液中弱酸分子浓度:c(HF)>c(HCN)
C. 甲溶液中:c(HF)=c(OH-)-c(H+) D. 乙溶液中: c(Na+)=c(CN-)+c(HCN)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】复分解反应能够发生是因为在这些反应物中含有一些“特殊”的阴、阳离子,它们能相互结合。如反应“BaCl2+Na2SO4![]() BaSO4↓+2NaCl”中,实际参加反应的离子是Ba2+和SO42-,而Cl、Na+则是“旁观者”,并没有参加反应。请你反应“K2CO3+2HCl=2KCl+CO2↑+H2O”中实际参加反应的离子是________;该反应的离子方程式是____________________________。请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀盐酸反应产物的示意图。
BaSO4↓+2NaCl”中,实际参加反应的离子是Ba2+和SO42-,而Cl、Na+则是“旁观者”,并没有参加反应。请你反应“K2CO3+2HCl=2KCl+CO2↑+H2O”中实际参加反应的离子是________;该反应的离子方程式是____________________________。请根据你的想象,在下图右边的容器中画出体现NaOH溶液和稀盐酸反应产物的示意图。
 ________
________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]是重要的无机化工产品。一种由白云石[主要成分为CaMg(CO3)2,还含少量SiO2、Fe2O3等]为原料制备碱式碳酸镁(国家标准中CaO的质量分数≤0.43%)的实验流程如下:

(1) “煅烧”时发生主要反应的化学方程式为____________________________。
(2)常温常压下“碳化”可使镁元素转化为Mg(HCO3)2,“碳化”时终点pH对最终产品中CaO含量及碱式碳酸镁产率的影响如图1和图2所示。
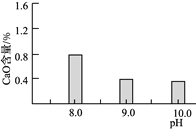

图1 CaO含量与碳化终点pH的关系 图2 碱式碳酸镁产率与碳化终点pH的关系
①应控制“碳化”终点pH约为________,发生的主要反应的化学方程式为______________________和____________________。
②图2中,当pH=10.0时,镁元素的主要存在形式是____________(写化学式)。
(3)“热解”生成碱式碳酸镁的化学方程式为________________________________。
(4)该工艺为达到清洁生产,可以循环利用的物质是____________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过反应 ,可制备有机中间体异氰酸苯酯。
,可制备有机中间体异氰酸苯酯。
(1) Ni3+基态核外电子排布式为________。
(2)异氰酸苯酯分子中碳原子杂化轨道类型是________,1 mol异氰酸苯酯分子中含有σ键数目为________。
(3)Na、O、C、N四种元素的第一电离能从大到小的顺序为_________________________。
(4) C2H5OH的沸点高于![]() ,这是因为__________________。
,这是因为__________________。
(5) Ni与Al形成的一种合金可用于铸造飞机发动机叶片,其晶胞结构如右图所示,该合金的化学式为________。
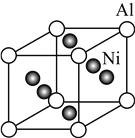
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:
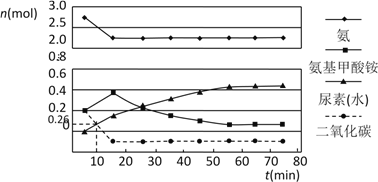
已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
(3)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气。电解时,阳极的电极反应式为________________________________。
Ⅱ.用焦炭还原NO2的反应为:2NO2(g)+2C(s )![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B) (填 “﹥”、“<”或“﹦”)。
②计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )
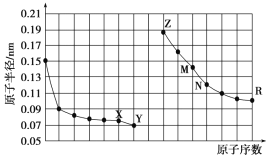
A. M、N的氧化物都能与Z、R的最高价氧化物对应水化物反应
B. Y的单质能从含R简单离子的水溶液中置换出R单质
C. X、M两种元素组成的化合物熔点很高
D. 简单离子的半径:R>M>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,下列各组中的离子一定能大量共存的是( )
A.K+、H+、SO42-、MnO4-B.Na+、Ca2+、Cl-、NO3-
C.Ag+、H+、Cl-、CH3COO-D.Ba2+、K+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3+2Al![]() Al2O3+2Fe所属基本反应类型是______。在该反应中______元素的化合价升高,该元素的原子______电子,被______。该反应中,Fe2O3发生了________反应,Al发生了______反应,______是氧化剂,__是还原剂,______是氧化产物,_____是还原产物。
Al2O3+2Fe所属基本反应类型是______。在该反应中______元素的化合价升高,该元素的原子______电子,被______。该反应中,Fe2O3发生了________反应,Al发生了______反应,______是氧化剂,__是还原剂,______是氧化产物,_____是还原产物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com