
【题目】洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如下图所示,有关洋蓟素的说法正确的是
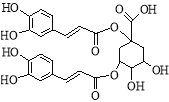
A.一定条件下能发生酯化反应和消去反应
B.结构中有2个手性碳原子
C.1mol洋蓟素最多可与6mol Br2反应
D.1mol洋蓟素最多可与9mol NaOH反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】“类推”是思维的一种形式,但往往也有不对的,下列“类推”中正确的是
A.Fe、Cu连接插在稀硫酸中形成的原电池,Fe为负极;那么Fe、Cu连接插在浓硝酸溶液中形成的原电池,Fe也为负极
B.Cl2+H2O![]() HCl+HClO是氧化还原反应,则ICl+H2O
HCl+HClO是氧化还原反应,则ICl+H2O![]() HCl+HIO也是氧化还原反应
HCl+HIO也是氧化还原反应
C.镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁
D.硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解,那么浓硝酸溶液也要保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯二氢硅(SiH2Cl2)常用于外延法工艺中重要的硅源。易燃、有毒,与水接触易水解,沸点8.2℃。在铜催化作用下,HCl与硅在25O-260℃反应可以制得SiH2Cl2。

(1)利用浓硫酸、浓盐酸为原料,选用A装置制取HCl,利用了浓硫酸的_____性。
(2)D装置中生成二氯二氢硅的化学方程式为____________。
(3)按照气体从左到右方向,制取SiH2Cl2的装置(h 处用止水夹夹好)连接次序为____________a→ ( ) → ( )→ ( )→ ( )→ ( )→ ( )→ ( )(填仪器接口的字母,其中装置C用到2次)。
(4)按从左到右的顺序,前面装置C中装的药品为________,后面装置C的作用为________。
(5)反应除生成二氯二氢硅之外,还会生成H2和______、____。
(6)新的制取SiH2Cl2方法是:往硅粉中先通入Cl2在300-350℃反应生成SiCl4,然后再与HCl在250-260℃反应,可以大大提高产率。如果通人气体次序相反,结果会_______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)比较原子半径的大小:O________F;(填“>”或“<”,下同)
(2)比较酸性强弱:H3PO4_______H2SiO3
(3)稳定性:NH3________PH3
II.写出下列物质形成过程的电子式:
(4)HCl_________________________
(5)MgCl2 ______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高一入学体检时,某同学体检的血液化验单中,出现了如下图所示的体检指标。表示该体检指标的物理量是( )
甘油三酯 | 0.52 | mmol/L |
总胆固醇 | 4.27 | mmol/L |
高密度脂蛋白胆固醇 | 1.57 | mmol/L |
低密度脂蛋白胆固醇 | 1.40 | mmol/L |
葡萄糖 | 4.95 | mmol/L |
A.溶解度 B.物质的量浓度 C.质量分数 D.摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L的混合溶液。
(1) 该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
; ; 。
(2) 该溶液中,浓度为0.01 mol/L的粒子是 ,浓度为0.002 mol/L的粒子是 。
(3) 和 两种粒子物质的量之和等于0.01 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的甲、乙同学分别设计了以下实验来验证元素周期律。
(Ⅰ)甲同学将钠,镁,铝各1mol分别投入到足量的盐酸中,预测实验结果:
(1)甲同学设计实验的目的是__________________________
(2)反应最剧烈的是______________
(3)将NaOH溶液与NH4Cl溶液混合生成NH3.H2O,从而验证NaOH的碱性强于NH3.H2O,继而验证Na的金属性大于N,你认为此设计是否合理?____________并说明理由:_____________.
(Ⅱ)乙同学设计了下图装置来探究碳、硅元素的非金属性强弱,根据要求完成下列各小题
(1)实验装置:

填写所示仪器名称A_________________B______________
(2)实验步骤: 连接仪器、____________、加药品后,打开a、然后滴入浓硫酸,加热。
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是________________________;
②装置E中的试剂为_________________________,作用是______________________,反应方程式_____________________________________________;
③能说明碳元素的非金属性比硅元素非金属性强的实验现象是_________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中短周期的一部分,其中Y元素的原子序数为M与N元素原子序数之和。下列说法正确的是
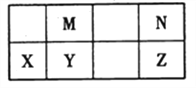
A. 氢化物的稳定性:N >Z,是因为其氢化物分子可形成氢键
B. 元素的非金属性:M > Y,是因为单质M能与YN2反应生成单质Y
C. 熔沸点:YN2>MN2,是因为YN2的分子间作用力强
D. 简单离子的半径:N >X,是因为它们具有相同的电子层结构且X的核电荷数更大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com