
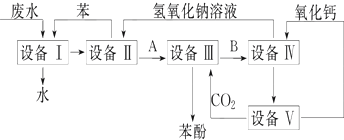
分析 由流程可知,设备Ⅰ中含有苯和工业废水,可经萃取、分液得到苯酚的苯溶液混合物,进入设备Ⅱ,设备Ⅱ加入氢氧化钠溶液,可得到苯酚钠,在设备Ⅲ中通入二氧化碳可得到苯酚,发生C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,设备Ⅳ中的主要物质为NaHCO3,在溶液中加入氧化钙,可生成氢氧化钠和碳酸钙沉淀.
(1)①苯萃取苯酚,加入过量的氢氧化钠溶液,苯酚和氢氧化钠反应,静置分液,据此即可解答;
②溶液上层为苯,下层为苯酚钠;
③苯酚钠溶液通入过量二氧化碳,生成苯酚和碳酸氢钠;
④物质B为碳酸氢钠溶液;
⑤根据生产流程图中的物质,找出反应物与生成物,然后分析生成物中的物质被用作反应物的即为可循环利用的物质;
(2)根据苯酚和氯化铁溶液之间的显色反应来回答;
(3)生成的沉淀为三溴苯酚,根据n=$\frac{m}{M}$计算出三溴苯酚的物质的量,根据反应可知该废水中含有苯酚的物质的量,再根据m=nM计算出苯酚的质量,最后计算出其浓度.
解答 解:(1)①工业废水与苯进入设备Ⅰ得到苯酚、苯的溶液与可以排放的无酚工业废水,说明在设备Ⅰ中进行的是萃取,利用苯与苯酚相似的结构互溶与水不溶,将苯酚从工业废水里提取出来,用分液的方法将下层的工业废水放出排放,上层的苯酚、苯混合液进入设备Ⅱ;萃取、分液必须用到的仪器名称叫分液漏斗,
故答案为:萃取、分液;分液漏斗;
②盛有苯酚、苯溶液的设备Ⅱ中注入氢氧化钠溶液,此时,具有酸性的苯酚跟氢氧化钠发生反应,生成苯酚钠和水,由设备Ⅱ进入设备Ⅲ的物质A是C6H5ONa,在设备Ⅱ中的液体分为两层,上层是苯层,下层是苯酚钠的水溶液,上层的苯通过管道送回设备Ⅰ中继续萃取工业废水中的苯酚,循环使用,下层的苯酚钠溶液进入设备(Ⅲ);在盛有苯酚钠溶液的设备Ⅲ中,通入过量的二氧化碳气,发生化学反应,生成苯酚和碳酸氢钠,
故答案为:C6H5ONa;NaHCO3;
③依据碳酸性比苯酚的酸性强,弱酸盐与“强”酸发生的复分解反应,二氧化碳和苯酚钠反应生成苯酚,反应的方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;
④盛有碳酸氢钠溶液的设备Ⅳ中,加入生石灰,生石灰与碳酸氢钠溶液里的水反应生成氢氧化钙,熟石灰和与碳酸氢钠发生复分解反应,生成沉淀;溶液与沉淀通过过滤分离,故答案为:CaCO3;过滤;
⑤设备Ⅴ应是石灰窑,CaCO3高温分解所得的产品是氧化钙和二氧化碳,所得二氧化碳通入设备Ⅲ,反应所得氧化钙进入设备Ⅳ.在含苯酚工业废水提取苯酚的工艺流程中,苯、氧化钙、CO2、和NaOH理论上应当没有消耗,它们均可以循环使用,
故答案为:CO2、NaOH;
(2)苯酚和氯化铁溶液之间会发生显色反应,向溶液中滴加FeCl3溶液,若溶液呈紫色,则表明污水中有苯酚,
故答案为:向污水中滴加FeCl3溶液,若溶液呈紫色,则表明污水中有苯酚;
(3)发生反应为苯酚与浓溴水反应,是苯酚分子中羟基对苯环影响,邻对位氢原子活泼,易于取代,反应的化学方程式为: ,得到沉淀0.331g为三溴苯酚,其物质的量为:$\frac{0.331g}{331g/mol}$=0.001mol,则100mL 该废水中含有苯酚的物质的量为0.001mol,质量为:94g/mol×0.001mol=0.094g,此废水中苯酚的含量为:$\frac{0.094g}{0.1L}$=0.94g/L=940mg/L,
,得到沉淀0.331g为三溴苯酚,其物质的量为:$\frac{0.331g}{331g/mol}$=0.001mol,则100mL 该废水中含有苯酚的物质的量为0.001mol,质量为:94g/mol×0.001mol=0.094g,此废水中苯酚的含量为:$\frac{0.094g}{0.1L}$=0.94g/L=940mg/L,
故答案为:940.
点评 本题考查物质的分离、提纯的基本方法和综合应用,为高频考点,涉及苯酚工业废水提取苯酚的工艺流程,侧重于学生的分析能力和实验能力的考查,根据苯和苯酚的性质进行解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 10℃20mL 3mol/L的X溶液 | B. | 20℃30mL 2mol/L的X溶液 | ||
| C. | 20℃10mL 4mol/L的X溶液 | D. | 10℃10mL 2mol/L的X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3+H2O═H2SO4 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | ||
| C. | Zn+H2SO4═ZnSO4+H2↑ | D. | AgNO3+HCl═AgCl↓+HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大于10种 | B. | 10种 | C. | 6种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
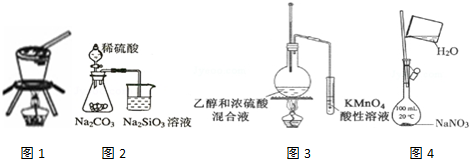
| A. | 用图1装置从饱和食盐水中提取NaCl晶体 | |
| B. | 用图2装置证明非金属性强弱 S>C>Si | |
| C. | 用图3装置验证乙烯的生成 | |
| D. | 用图4装置配制一定物质的量浓度的NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -386kJ•mol-1 | B. | +386kJ•mol-1 | C. | -746kJ•mol-1 | D. | +746kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用高锰酸钾酸性溶液鉴别苯和正己烷 | |
| B. | 苯和浓溴水反应制溴苯 | |
| C. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 | |
| D. | 用CuSO4溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com