
【题目】2-苯基丙烯酸(俗名阿托酸)是一种重要的医药中间体、材料中间体,其工业合成方法(从F开始有两条合成路线)如下:

已知:i. ![]()
ii. ![]()
iii. 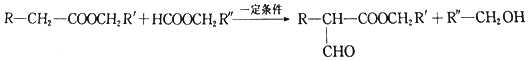
回答下列问题:
(1)C的名称为_____________,反应④的反应类型为___________________。
(2)检验E是否完全转化为F的试剂是________________________。
(3)反应③的化学方程式为_______________________。
(4)D的同分异构体有多种,符合下列条件的D的同分异构体有______________,其中苯环上的一元取代物有2种的结构简式为___________________ 。
①能发生银镜反应 ②能与FeCl3溶液发生显色反应
③核磁共振氢谱的峰面积比为6:2:2:1:1
(5)路线二与路线一相比不太理想,理由是_____________________。
(6)参照上述合成路线,设计一条由CH3COOH制备HOOCCH2COOH的合成路线。(合成路线的表示方法为:A![]() B……
B……![]() 目标产物)___________________
目标产物)___________________
【答案】 苯乙酸 加成反应(或还原反应) 新制氢氧化铜悬浊液(或银氨溶液)  3
3  由于H既有羟基又有羧基,所以在浓硫酸作用下发生消去反应时,会生成酯类副产物,影响2-苯基丙烯酸的产率
由于H既有羟基又有羧基,所以在浓硫酸作用下发生消去反应时,会生成酯类副产物,影响2-苯基丙烯酸的产率 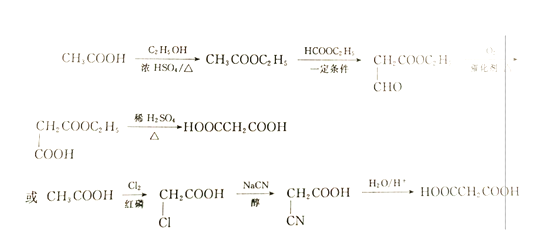
【解析】根据题意:M是甲苯,A是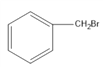 ,B是
,B是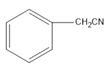 ,C是
,C是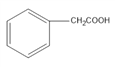 ,D是
,D是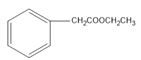 ,G是
,G是 ,H是
,H是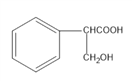 。
。
(1)C是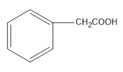 ,名称为苯乙酸,反应④由E生成F,醛基被氢气还原,反应类型为加成或还原反应;
,名称为苯乙酸,反应④由E生成F,醛基被氢气还原,反应类型为加成或还原反应;
(2)检验E是否完全转化为F,即检验醛基即可,用新制氢氧化铜悬浊液或银氨溶液;
(3)反应③由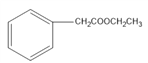 和
和![]() 生成
生成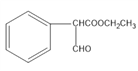 ,根据
,根据 信息的提示,化学方程式为
信息的提示,化学方程式为 ;
;
(4)D是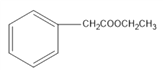 ,其同分异构体有多种,要满足①能发生银镜反应,说明有醛基②能与FeCl3溶液发生显色反应,说明有酚羟基③核磁共振氢谱的峰面积比为6:2:2:1:1,说明有5种H,且数目比为6:2:2:1:1;这样的结构有:
,其同分异构体有多种,要满足①能发生银镜反应,说明有醛基②能与FeCl3溶液发生显色反应,说明有酚羟基③核磁共振氢谱的峰面积比为6:2:2:1:1,说明有5种H,且数目比为6:2:2:1:1;这样的结构有: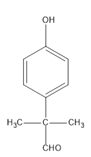
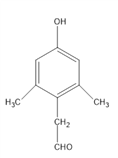
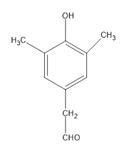 ,共3种,其中苯环上的一元取代物有2种的结构简式为
,共3种,其中苯环上的一元取代物有2种的结构简式为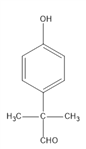 ;
;
(5)路线一是先消去,后水解,路线二是先水解后消去,得到H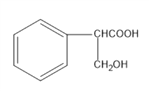 ,由于H既有羟基又有羧基,所以在浓硫酸作用下发生消去反应时,会生成酯类副产物,影响2-苯基丙烯酸的产率,相比与线路一不太理想;
,由于H既有羟基又有羧基,所以在浓硫酸作用下发生消去反应时,会生成酯类副产物,影响2-苯基丙烯酸的产率,相比与线路一不太理想;
(6)参照上述合成路线,设计一条由CH3COOH制备HOOCCH2COOH的合成路线,根据原料与目标产物的对比分析,在原料中需要加碳原子,且该碳原子为羧基,故根据提示信息,合成路线设计如下:
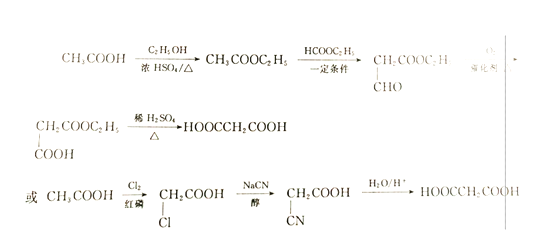 。
。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】氢能是一种高效清洁、极具发展潜力的能源。利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。
已知下列反应:
反应I:CH3CH2OH(g)+H2O(g) ![]() 2CO(g)+4H2(g) △H1
2CO(g)+4H2(g) △H1
反应Ⅱ:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g) △H2
CO2(g)+ H2(g) △H2
反应Ⅲ:2 CO2(g)+ 6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H3
CH3CH2OH(g)+3H2O(g) △H3
反应Ⅳ:6H2(g)+2CO2(g) ![]() CH2=CH2(g)+4H2O(g) △H4
CH2=CH2(g)+4H2O(g) △H4
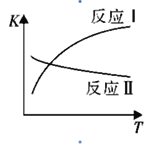
(1)反应I和反应II的平衡常数随温度变化曲线如图所示。则△H1 _________△H2(填“>”、“<”或“=”);△H3=_________(用△H1、△H2表示)。
(2)向2L密闭容器中充入H2和CO2共6mol,改变氢碳比[n(H2)/n(CO2)]在不同温度下发生反应III达到平衡状态,测得的实验数据如下表。分析表中数据回答下列问题:
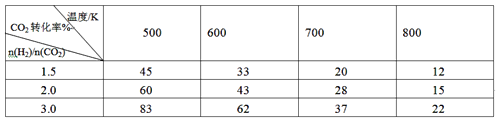
①温度升高,K值__________(填“增大”、“减小”、或“不变”)。
②提高氢碳比,K值____(填“增大”、“减小”、或“不变”),对生成乙醇______(填“有利”或“不利”)。
③在700K、 氢碳比为1.5,若5min反应达到平衡状态,则0~5min用H2表示的速率为__________。
(3)反应III在经CO2饱和处理的KHCO3电解液中,电解活化CO2制备乙醇的原理如图所示。
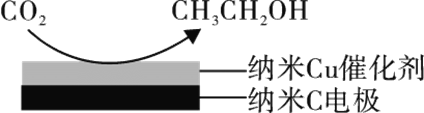
①阴极的电极反应式为________。
②从电解后溶液中分离出乙醇的操作方法为________。
(4)在一定条件下发生反应Ⅳ,测得不同温度对CO2的平衡转化率及催化剂的效率影响如图所示,下列有关说法正确的为________(填序号)。
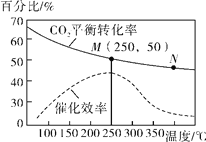
①不同条件下反应,N点的速率最大
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随温度升高乙烯的产率增大
④实际反应应尽可能在较低的温度下进行,以提高CO2的平衡转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)为第五周期元素,与氧同主族,其单质和化合物在化工生产等方面具有广泛应用。
(1)画出碲的原子结构示意图___________________。
(2)已知TeO2微溶于水,易溶于较浓的强酸和强碱。写出TeO2溶于浓氢氧化钠溶液的离子方程式_________________________。
(3)工业上用铜阳极泥(主要成分为Cu2Te,还含有少量的Ag、Au)为原料制备单质碲的工艺流程如下:

①“加压浸出”过程中被氧化的元素为_____________(填元素符号),1molCu2Te被“浸出”时氧化剂得到的电子数为___________________。
②“酸浸”时,温度过高会使碲的浸出率降低,原因为____________________。
③“还原”过程的化学方程式为____________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3溶液,然后再通过电解的方法得到单质碲,阴极的电极反应式为______________________ 。
(4)25℃时,向1mol·L-1的Na2TeO3溶液中滴加盐酸,当溶液pH约为6时,此时溶液中c(HTeO3-):c(TeO32-)=_____________。(H2TeO3的Ka1=1.0×10-3,Ka2=2.0×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用盐酸的质量分数为36.5%,密度为1.20g/3。
⑴此浓盐酸的物质的量浓度是多少?_______________(列式计算)
⑵配制100mL3.00mol/L的盐酸,需以上浓盐酸多少mL? ______________(列式计算)
⑶用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):_____________________ 。
①计算②装瓶③用50mL量筒量取一定体积的浓盐酸④洗涤⑤移液⑥稀释⑦定容⑧摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴、铁、镓、砷的单质及其化合物在生产生活中有重要的应用,请回答下列问题:
(1)写出砷(As)的基态原子的电子排布式_________。
(2)N、P、As为同一主族元素,其电负性从大到小的顺序为_______,它们的简单氢化物沸点最高的是______,将NaNO2和Na2O在一定的条件下反应得到一种白色晶体,已知其中的阴离子与SO42-互为等电子体,则该阴离子的化学式为________。
(3)Fe3+、Co3+、N3+-、CN-等可形成络合离子。
①K3Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为________。
②[Co(N3)(NH3)5]SO4中Co的配位数为_______,其配离子中含有的化学健类型为_____(填离子键、共价键、配位键),C、N、O的第一电离能最大的是_____,其原因是_______。
(4)砷化镓晶胞结构如图。晶跑中Ga与周围等距且最近的砷形成的空间构型为_____,已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的数值为______(列出计算式即可)。
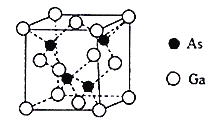
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:
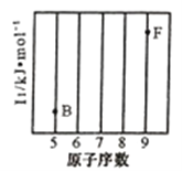
(1)参照下图B、F元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出C、N、O三种元素的相对位置。_________
(2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为__________________。
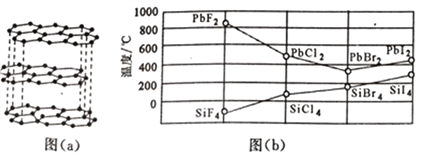
(3)二卤化铅PbX2的熔点如图(b)所示,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性__________(填“增强”、“ 不变”或“减弱”,下同),共价性__________。
(4)NH3和F2在Cu催化下可发生反应4NH3+3F2![]() NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____(填序号)。写出基态铜原子的价电子排布式_____________。
NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_____(填序号)。写出基态铜原子的价电子排布式_____________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(5)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
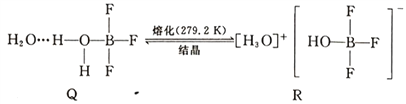
晶体R中含有的化学键包括____________。
(6)水杨酸第一级电离形成离子![]() ,相同温度下,水杨酸的Ka2_________苯酚(
,相同温度下,水杨酸的Ka2_________苯酚(![]() )的Ka(填“>”“ =”或“<”),其原因是_______________。
)的Ka(填“>”“ =”或“<”),其原因是_______________。
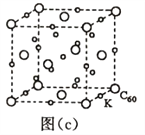
(7)碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为_____________;其晶胞参数为1.4nm,阿伏加德罗常数用NA表示,则晶体的密度为_________g·cm-3。(只需列出式子)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com