
| A. | NaOH溶液 | B. | 浓氨水 | C. | NaCl溶液 | D. | Na2SO4溶液 |
分析 Al3+可以和碱反应,也可以和能水解显碱性的盐反应;Al(OH)3是两性氢氧化物能溶于强酸强碱,Al3+离子全部沉淀需要所加的试剂过量,所以全部沉淀Al3+最好不用强碱用弱碱,以此解答该题.
解答 解:A.氢氧化钠是强碱,能使部分氢氧化铝转化为偏铝酸钠,所以不能使铝离子完全转化为沉淀,故A错误;
B.氨水属于弱碱,氢氧化铝不溶于弱碱,所以可以将铝离子完全沉淀下来,故B正确;
C.氯化钠和铝离子不反应,故C错误;
D.硫酸钠和铝离子不反应,所以得不到沉淀,故D错误.
故选B.
点评 本题考查了氢氧化铝的制取,为高频考点,侧重考查学生的分析能力,明确氢氧化铝的性质是解本题关键,氢氧化铝是中学阶段学习的唯一一个氢氧化物,能溶于强碱但不溶于弱碱,所以实验室用可溶性铝盐和氨水制取氢氧化铝沉淀.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 盐的电离平衡被破坏 | B. | 溶液温度升高 | ||
| C. | 25℃,溶液的pH不是7 | D. | 水的电离平衡被破坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HS-)>c(K+)>c(S2-)>c(OH-)>c(H-) | B. | c(H+)>c(OH-) | ||
| C. | 2c(K+)+c(H+)═c(HS-)+2c(S2-) | D. | c(OH-)+c(S2-)=c(H+)+c(HS-)+2c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 平行次数 | 1 | 2 | 3 |
| 0.250g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
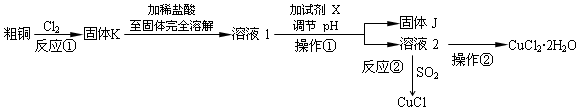
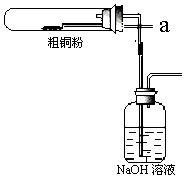
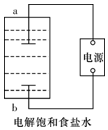 某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:
某兴趣小组模拟氯碱工业生产原理并探究其产品的性质.已知文献记载:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 10 | C. | 104 | D. | 10-4 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
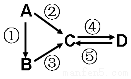 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com