
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”.以钛铁矿(主要成分FeTiO3 , 钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1: 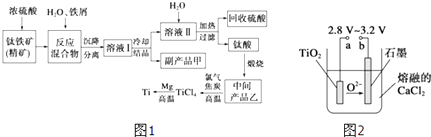
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4 , 反应中无气体生成.副产品甲阳离子是 .
(2)上述生产流程中加入铁屑的目的是 .
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如下表所示.
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10﹣16 | 1.0×10﹣29 | 1.8×10﹣11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018molL﹣1 , 当溶液的pH等于时,Mg(OH)2开始沉淀.
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是 .
(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的极,阴极的电极反应式 .
【答案】
(1)Fe2+
(2)防止Fe2+氧化
(3)10;TiO2++2H2O═H2TiO3↓+2H+
(4)隔绝空气
(5)正;TiO2+4e﹣═Ti+2O2﹣
【解析】解:(1)加入过量铁屑后溶液中含有Fe2+离子,所以答案是:Fe2+;(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4 , 加入铁屑,可防止Fe2+氧化,所以答案是:防止Fe2+氧化;(3)①Ksp[Mg(OH)2]=c(Mg2+)×c2(OH﹣)=1.8×10﹣11 , 故c(OH﹣)= ![]() =10﹣4 , 故c(H+)=
=10﹣4 , 故c(H+)= ![]() =10﹣10 , 故此时pH=10,所以答案是:10;②已知TiO2+发生水解生成钛酸(H2TiO3)沉淀和氢离子,其离子方程式为:TiO2++2H2O═H2TiO3↓+2H+ , 所以答案是:TiO2++2H2O═H2TiO3↓+2H+; TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+;(4)为防止碳与氧气反应,应可绝空气加热,所以答案是:隔绝空气;(5)电解池的阳极是氧离子发生失电子的氧化反应,导致氧气等气体的出现,所以电极反应式为:2O2﹣→O2↑+4e﹣ , 电解池的阴极发生得电子的还原反应,是二氧化钛电极本身得电子的过程,即TiO2+4e﹣→Ti+2O2﹣;电解池中,电解质里的阴离子O2﹣、Cl﹣均移向阳极,所以答案是:正;TiO2+4e﹣→Ti+2O2﹣ .
=10﹣10 , 故此时pH=10,所以答案是:10;②已知TiO2+发生水解生成钛酸(H2TiO3)沉淀和氢离子,其离子方程式为:TiO2++2H2O═H2TiO3↓+2H+ , 所以答案是:TiO2++2H2O═H2TiO3↓+2H+; TiO2++2H2O═TiO(OH)2↓(或H2TiO3)+2H+;(4)为防止碳与氧气反应,应可绝空气加热,所以答案是:隔绝空气;(5)电解池的阳极是氧离子发生失电子的氧化反应,导致氧气等气体的出现,所以电极反应式为:2O2﹣→O2↑+4e﹣ , 电解池的阴极发生得电子的还原反应,是二氧化钛电极本身得电子的过程,即TiO2+4e﹣→Ti+2O2﹣;电解池中,电解质里的阴离子O2﹣、Cl﹣均移向阳极,所以答案是:正;TiO2+4e﹣→Ti+2O2﹣ .


科目:高中化学 来源: 题型:
【题目】某离子化合物中,阳离子和阴离子的电子层结构与氖原子电子层结构相同,则此离子化合物化学式为( )
A. MgOB. NaClC. SiO2D. K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡,反应过程中测定的数据如下表.下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10﹣5mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向aL密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(s)+2Y(g)2Z(g),能判断该反应达平衡状态的是( )
A.容器内气体压强不随时间变化
B.容器内气体密度不随时间变化
C.容器内X,Y,Z的浓度之比为1:2:2
D.X的消耗速率和Z的生成速率之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学以碳棒为电极电解CuCl2溶液时,发现阴极碳棒上除了有红色物质析出外,还有少量白色物质析出.为探究阴极碳棒上的产物,同学们阅读资料并设计了如下过程:
Ⅰ.有关资料:铜的化合物颜色性质如下
物质 | 颜色、性质 | 物质 | 颜色、性质 |
氢氧化铜Cu(OH)2 | 蓝色固体不溶于水 | 硫酸铜(CuSO4) | 溶液呈蓝色 |
氧化亚铜(Cu2O) | 红色固体不溶于水 | 氯化铜(CuCl2) | 浓溶液呈绿色,稀溶液呈蓝色 |
氯化亚铜(CuCl) | 白色固体不溶于水 | 碱式氯化铜 | 绿色固体不溶于水 |
Ⅱ.探究实验:
(1)提出假设:
①红色物质一定有铜,还可能有Cu2O;
②白色物质为铜的化合物,其化学式可能为 .
(2)实验验证:
取电解CuCl2溶液后的阴极碳棒,洗涤、干燥,连接下列装置进行实验,验证阴极产物,
①实验前,检查装置A气密性的方法是 .
②实验时,各装置从左至右的连接顺序为A→→→B→→
(3)观察现象,得出结论
实验结束后,碳棒上的白色物质变为红色,F中物质不变色,D中出现白色沉淀,根据现象①碳棒上的红色物质是否有Cu2O(填“是”或“否”),理由是;
②装置(填上图中装置编号)中的现象说明提出假设②中的白色物质一定存在;
③写出装置B中发生反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁是生活中非常常见的金属,运用所学知识回答:
(1)金属铝是活泼的金属,但在生活中的应用仍很广泛,原因是 .
(2)在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示) .
(3)写出还原铁粉与水蒸气反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各实验装置图的叙述中,正确的是( ) 
A.装置①可用于分离碘和氯化钠的固体混合物
B.装置②可用于吸收HCl或NH3气体
C.装置③可用于分解NH4HCO3制备NH3
D.装置④b口进气可收集CO2或NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3 , 溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w= ![]() ×100%
×100%
②c= ![]()
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w.
A.①③
B.②③
C.①②
D.只有②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com