
 ,
, ;
;| 11.2L |
| 22/4L/mol |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
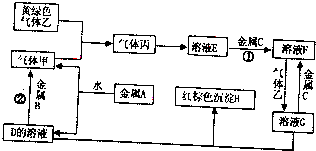
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、从海水中获取物质必须经过化学变化 |
| B、工业上以氯气和澄清石灰水为原料制取漂白粉 |
| C、海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
| D、氯气泄漏现场应采取喷水雾、喷碱性液体,并杜绝火源、电源等措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学平衡常数均无单位 |
| B、平衡常数越大则转化率越大 |
| C、对于一个化学计量数固定的反应,平衡常数的大小只与温度有关 |
| D、在平衡常数表达式中,反应物的浓度为初始浓度,生成物的浓度为平衡浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Y与R形成的化合物对应的水化物一定是强酸 |
| B、如W与Y形成化合物的化学式为WY2,则WY2能与碱反应,但不能与任何酸反应 |
| C、原子半径按X、Y、W、R、Z的顺序依次增大 |
| D、R的气态氢化物一定比W的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铜溶液与铁粉反应:CuCl2+Fe═Fe2++Cu+2Cl- |
| B、稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ |
| C、氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ |
| D、用氢氧化钠溶液吸收氯化氢气体:H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com