
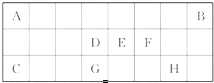
 下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.
下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、B的气态氢化物稳定性较C的强 |
| B、C与D形成的一种化合物与水反应能产生C2单质 |
| C、均由A、C、D、E四种元素形成的两种盐不能相互反应 |
| D、B的最高价氧化物对应的水化物与其最低价氢化物反应生成的化合物为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | Al | Fe |
| 熔点(℃) | 660 | 1535 |
| 沸点(℃) | 2467 | 2750 |
| 所用试剂 | NaOH溶液 |
| 实验操作及现象 | 取少许 |
| 有关反应的化学方程式 | 2Al+2NaOH+2H2O→2NaAlO2+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
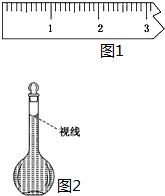 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
IA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )| A、X元素的原子有二个电子层,处于周期表的第14纵行 |
| B、X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 |
| C、Z的原子序数为31,单质常温下为液体 |
| D、气态氢化物水溶液的酸性X<Z<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和②分子中碳原子数大于10 |
| B、①和②常温常压下不为气态 |
| C、①和②均能与Na反应放出氢气 |
| D、②的分子式为C12H24O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com