
【题目】硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
(1)将0.050 mol SO2和0.030 mol O2放入容积为1 L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol/L。
①从平衡角度分析采用过量O2的目的是________________________;
②计算该条件下反应的平衡常数K=________________________。
③已知:K(300℃)>K(350℃),该反应是________热反应。若反应温度升高,SO2的转化率________ (填“增大”、“减小”或“不变”)。
(2)某温度下,SO2的平衡转化率(![]() )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”,下同)。
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”,下同)。
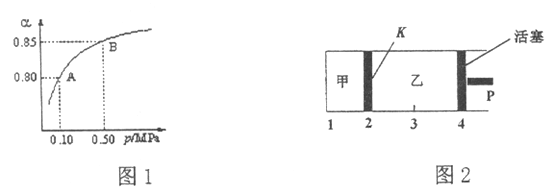
(3)如图2所示,保持温度不变,将2 mol SO2和1 mol O2加入甲容器中,将4 mol SO3加入乙容器中,隔板K不能移动。此时控制活塞P,使乙的容积为甲的2倍。
①若移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲______乙。
②若保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲_______乙。
【答案】 提高二氧化硫的转化率 1600 放热 减小 = < >
【解析】(1)①加入过量的氧气的目的是使平衡正向移动,提高二氧化硫的转化率。
② 2SO2(g)+ O2(g)![]() 2SO3(g)
2SO3(g)
起始: 0.05 0.03 0
反应: 0.04 0.02 0.04
平衡: 0.01 0.01 0.04
所以K=0.042/(0.042×0.01)=1600。
③K(300℃)>K(350℃),即温度升高K值减小,所以该反应是放热反应。放热反应,升高温度,平衡逆向移动,二氧化硫的转化率减小。
(2)平衡常数只与温度有关,所以平衡常数K(A)= K(B)。
(3)①根据等效平衡原理,乙中加入4molSO3就相当于加入4molSO2和2molO2,移动活塞P,使乙的容积和甲相等,可以认为是甲、乙恒容且体积相等,即初始浓度乙是甲的2倍。恒容下,所有反应物同时同等比例增大浓度,体积分数的变化相当于未增加反应物,直接减小体积增大压强。即从甲变为乙相当于增大压强。因为增大压强,平衡正向移动,所以SO3的体积分数增大,即移动活塞P,使乙的容积和甲相等,达到新平衡时,SO3的体积分数甲<乙。
②第一次达平衡时,甲、乙中SO3的体积分数一定相等(乙的投料量是甲2倍,但是体积也是甲2倍),甲恒容,通入稀有气体,平衡不移动。乙恒压,通入稀有气体,P向右移动,相当于增大体积减小压强,平衡逆向移动,SO3的体积分数减小。因此,保持乙中压强不变,向甲、乙容器中通入等质量的氦气,达到新平衡时,SO3的体积分数甲>乙。


科目:高中化学 来源: 题型:
【题目】CaH2常作为生氢剂,其中氢元素呈﹣1价,其化学方程式为CaH2+2H2O═Ca(OH)2+2H2↑,其中水是( )
A.还原剂
B.氧化剂
C.既是还原剂又是氧化剂
D.既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如图:
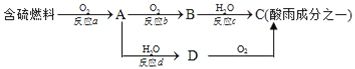
请回答下列问题:
①酸雨的pH_____(填“>”、“<”或“=”)5.6;
②D物质的化学式为_____;
③反应b的化学方程式为_____;
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质.写出氨气和二氧化氮在一定条件下反应生成氮气和水的化学方程式:____________________,反应中氧化剂是____;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质进行一氯取代后,生成的产物只有2种的是
A.(CH3)2CHCH(CH3)2
B.(CH3)3CCH2CH3
C.(CH3CH2)2CHCH3
D.(CH3)4C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2gCu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是_____________生成SO2的体积为(标准状况下)____________mL.
(2)若题干中浓硫酸的物质的量浓度为amol/L,投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)____0.025amol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,则原浓硫酸的物质的量浓度为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1mol Na2CO3与盐酸混合所得溶液的体积为1L,溶液中部分微粒浓度与pH 的关系如图所示。下列有关叙述正确的是

A. 随溶液pH增大,c(CO32-)/c(HCO3-)的值先减小后增大
B. 25℃时,碳酸的第一步电离常数Ka1=10-6
C. pH=4 的溶液中:c(H2CO3)+ c(HCO3-)+ c(CO32-)=0.1mol/L
D. b点所示的溶液中:c(Na+)+c(H+)= 2c(CO32-)+c(OH-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2) 和亚硫酰氯(SOCl2) 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
已知:①SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
②SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
(1)反应2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。
2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。

(3)为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)= 8.0×10-3mo1·L-1·min-1,则平衡时SO2Cl2的转化率α1=_______。若其它条件保持不变,反应①在恒压条件下进行,平衡时SO2Cl2的转化率α2_____α1(填“>”、“<”或“=”)。若要增大SO2Cl2的转化率,可以采取的措施有______(列举一种)。
(4)锂亚硫酰氯(Li/SOCl2) 电池是一种大容量电池,该电池用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4) 溶解在亚硫酰氣(SOCl2)中形成的,其电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
①写出电池工作时正极的电极反应式_____________;
②若用此电池做电源,以铂作电极电解200mL 0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,电池负极消耗锂的质量是______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiPF6是锂离子电池中广泛应用的电解质。某工厂用LiF、PCl5为原料,低温反应制备LiPF6,其流程如下:

已知:HCl的沸点是—85.0℃,HF的沸点是19.5℃。
(1)第①步反应中无水HF的作用是____________、_____________。无水HF有腐蚀性和毒性,工厂安全手册提示:如果不小心将HF沾到皮肤上,可立即用2%的_______溶液冲洗。
(2)该流程需在无水条件下进行,第③步反应中PF5极易与水反应,其产物为两种酸,写出PF5与水反应的化学方程式:________________________________________。
(3)第④步分离采用的方法是_______;第⑤步分离尾气中HF、HCl采用的方法是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.含有大量Ba2+的溶液:Cl﹣ K+ SO42﹣ CO32﹣
B.含有大量H+的溶液:Mg2+ Na+ SO42﹣ CO32﹣
C.含有大量 OH﹣的溶液:Cu2+ NO3﹣ SO42﹣ CO32﹣
D.含有大量Na+的溶液:H+ K+ SO42﹣ NO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com