
把100 mL 0.3 mol·L-1 的硫酸溶液和50 mL 0.6 mol·L-1的硫酸溶液充分混合后,该溶液中H+的物质的量浓度为( )
A.0.6 mol·L-1 B.0.8 mol ·L-1
·L-1
C.0.3 mol·L-1 D.0.4 mol·L-1
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源:2016-2017学年湖北省天门市三校高一上学期期中化学试卷(解析版) 题型:选择题
菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有五价砷(As),西红柿中含有比较多的维生素C,两者同食时会生成有毒的三价砷。下列说法正确的是( )
A.因为河虾中含有砷元素,所以不能食用
B.“两者同食”发生的反应中维生素C作氧化剂
C.五价砷在维生素C作用下发生了还原反应
D.已知砒霜的主要成分是氧化砷,可以推测所含的砷元素化合价为+5
查看答案和解析>>
科目:高中化学 来源:2017届湖北省老河口市高三10月月考化学卷(解析版) 题型:选择题
下列溶液中,有关离子一定能大量共存的是( )
A.能使石蕊呈蓝色的溶液中: Na+、I-、Cl-、NO3-
B.能使甲基橙呈黄色的溶液中:K+、SO32-、SO42-、ClO-
C.能使pH试纸变蓝色的溶液中:Mg2+、Fe3+、NO3-、[Ag(NH3)2]+
D.能跟金属铝反应生成氢气的溶液中:NH4+、Al3+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2017届湖北省老河口市高三10月月考化学卷(解析版) 题型:选择题
25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A.2H2(g) + O2(g) == 2H2O(1) △H= ―285.8kJ/mol
B.2H2(g) + O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C.2H2(g) + O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D.H2(g) + 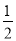 O2(g) == H2O(1) △H= ―285.8kJ/mol
O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源:2017届湖北省老河口市高三10月月考化学卷(解析版) 题型:选择题
下列说法中正确的是 ( )
A.任何一个水分子,其本身都是固体
B.逐渐加热升温,碳酸氢铵也可体现出三态变化
C. 面包是固体,但在受压时体积缩小,故可以说固体易被压缩
面包是固体,但在受压时体积缩小,故可以说固体易被压缩
D.在水蒸气、液态水和冰中,水分子都在不停地运动
查看答案和解析>>
科目:高中化学 来源:2017届广西钦州市高新区高三11月月考化学试卷(解析版) 题型:选择题
如图为两种途径制备硫酸的过程(反应条件略),下列说法不正确的是( )
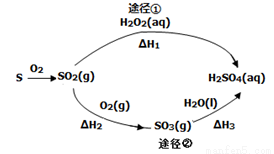
A.途径②增大O2浓度可提高SO2转化率
B.含 l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
l mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热
C.途径②中SO2和SO3均属于酸性氧化物
D.若△Hl<△H2+△H3,则2H2O2(aq)=2H2O(1) +O2 (g)为放热反应
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考一化学卷(解析版) 题型:填空题
【物质结构与性质】 (15 分)
钒、砷均属于第四周期元素,最高正价均为+5。
I .高纯度砷可用于生产具有“半导体贵族”之称的新型半导体材料GaAs,砷与氯气反应可得到 AsCl3、AsCl5两种氯化物。
(1)AsCl3分子的空间构型是 ,中心原子杂化类型是 。两种氯化物分子中属于非极性分子的是 。
(2)Ga与As相比,第一电离能较小的元素是 ,GaAs中砷的化合价为 。
II.钒是一种重要的战略金属,其最主要的用途是生产特种钢,其化合价有+5、+4、+3、+2等,工业上从炼钢获得的富钒炉渣中(内含 V2O5)提取钒的过程如下。

(3)基态钒原子的价电子排布式为 ,写出反应①的化学方程式: 。
(4)已知单质钒的晶胞为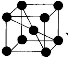 ,则 V 原子的配位数是 ,假设晶胞的边长为 a cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
,则 V 原子的配位数是 ,假设晶胞的边长为 a cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上联考一化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.乙烯和甲烷都能发生加成反应
B.米酒变酸是因为乙醇被氧化为乙酸
C.糖类、油脂、蛋白质都属于天然高分子化合物
D.可用热的NaOH溶液除去乙酸乙酯中的乙酸杂质
查看答案和解析>>
科目:高中化学 来源:2017届安徽省江淮十校高三11月质检化学试卷(解析版) 题型:选择题
向含Cr2O72—的酸性废水中加入FeSO4,充分反应后,再加入石灰水调节溶液的pH,使Cr3+转化为Cr(OH)3沉淀,而从废水中除去,下列说法不正确的是
A.上述发生了氧化还原反应,FeSO4在反应中作还原剂
B.若该反应转移0.6mole—,则会有0.2molCr2O72—被还原
C.随着反应的进行,该废水的pH会增大
D.除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com