
【题目】用 NA 表示阿伏加德罗常数的值。下列说法正确的是
A.含有 NA 个氦原子的氦气在标准状况下的体积约为11.2 L
B.标准状况下,11.2 L由N2 与CO组成的混合气体含有的原子数目为NA
C.标准状况下,22.4 L的H2O中含有的水分子数为NA
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】无水三氯化铬(CrCl3)为紫色晶体,在工业上主要用作媒染剂和催化剂,某化学小组用Cr2O3和CCl4在高温下制备无水三氯化铬,部分实验装置如图所示。
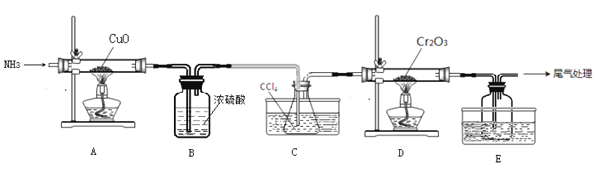
已知:①CrCl3熔点为83℃,易潮解,易升华,易溶于水但不易水解,高温下易被氧气氧化;②Cr2O3和CCl4在高温下反应的产物为CrCl3和光气(COCl2 )。请回答下列问题:
(1)装置A是氮气制备装置,氮气的作用是____________。
(2)装置B的作用为________。装置C和装置E的水槽中应分别盛有__________、____________。
(3)装置D中生成CrCl3和光气(COCl2 )的化学方程式为_________。
(4)该实验装置有设计不合理的地方,请写出改进方法:_________(写一点即可)
(5)产品中CrCl3质量分数的测定:
(i)称取0.3000 g得到的CrCl3样品溶于水并于250mL容量瓶中定容。
(ii)取25.00mL样品溶液于带塞的锥形瓶中,加热至沸腾后加入稍过量的Na2O2,稀释并加热煮沸,再加入过量的H2SO4酸化,将Cr3+氧化为Cr2O72-;再加入过量的KI固体,加塞摇匀,使铬完全以Cr3+形式存在
(iii)加入1mL指示剂,用0.0250 mol·L-1标准Na2S2O3溶液滴定至终点,平行测定三次,平均消耗标准Na2S2O3溶液21.00mL(已知2Na2S2O3+I2= Na2S4O6+2NaI)
①ii中加入稍过量的Na2O2后要加热煮沸,其主要原因是____________;加入KI发生反应的离子方程式为________________
②滴定实验可选用的指示剂为____________产品中CrCl3质量分数为_______%(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如右下表。下列有关说法正确的是( )
溶质 | pH |
NaF | 7.5 |
Na2CO3 | 11.6 |
NaClO | 9.7 |
NaHCO3 | 8.3 |
A. 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数为1×10-13
HF+OH-的平衡常数为1×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是
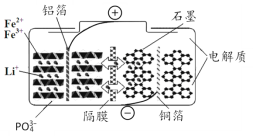
A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3,[Fe(H2NCONH2)6](NO3)3等。
(1)Fe2+基态核外电子排布式为___。
(2)与CN-互为等电子体的一种分子是:___,CN-可在TiO2作光催化剂下转化为OCN-,OCN-中三种元素的电负性由大到小的顺序为___,尿素(H2NCONH2)分子中C、N原子的杂化方式分别为___和___。
(3)NO3-的空间构型为___,1molFe(CN)63-中含有σ键的数目为___。
(4)铁的另一种配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则X=___,已知该配合物的熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)X晶体属于___(填晶体类型)。
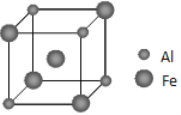
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。则这种晶胞中,离Al原子最近且距离相等的Fe原子有___个,该晶体的密度的计算式为:___(不用化简,已知小立方体的边长为acm,阿伏伽德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气主要污染物,有效去除大气中的NOx是环境保护的重要课题。
(1)N2O又称笑气,有轻微的麻醉作用,N2O在一定条件下可分解为N2、O2。回答下列问题:
已知:①N2(g)+O2(g)=2NO(g) △H1=+180.5kJmol-1
②2NO(g)+O2(g)=2NO2(g) △H2=-114.14kJmol-1
③3NO(g)=N2O(g)+NO2(g) △H3=-115.52kJmol-1
则反应2N2O(g)=2N2(g)+O2(g) △H=_______ kJmol-1
(2)汽车尾气中的NO和CO可在催化剂作用下生成无污染的气体而除去。在密闭容器中充入10molCO和8molNO发生反应,测得平衡时NO的体积分数与温度、压强的关系如下图

①已知T2>T1,则反应2NO(g)+2CO(g)![]() 2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
2N2(g)+2CO2(g),△H___0(填“>”“=”或“<”)
②该反应达到平衡后,为同时提高反应速率和NO的转化率,可采取的措施有____(填字母序号)
a.改用高效催化剂 b.缩小容器的体积 c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,若反应进行到20min达到平衡状态,此时容器的体积为4L,则用N2的浓度变化表示的平均反应速率v(N2)=____,该温度下用分压表示的平衡常数Kp= ___MPa-1(分压=总压×物质的量分数)。
④在D点,对反应容器升温的同时扩大体积至体系压强减小,重新达到的平衡状态可能是图中A~G点中____点。
(3)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2,将一定比例的O2、NH3和NOx的混合气体匀速通入装有催化剂M的反应器中反应,反应相同时间,NOx的去除率随反应温度的变化曲线如图所示。

①在50℃~150℃范围内随温度升高,NOx的去除率迅速上升的原因是____。
②当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com