
【题目】沉淀溶解平衡在在生活生产中有着重要应用.
(1)粗制![]() 晶体中常含有杂质
晶体中常含有杂质![]() .
.
①在提纯时为了除去![]() ,常加入合适氧化剂,使
,常加入合适氧化剂,使![]() 氧化为
氧化为![]() ,下列物质最好选用的是 ______ .
,下列物质最好选用的是 ______ .
A. ![]()
![]()
![]() 氯水
氯水![]()
![]() 然后再加入适当物质调整溶液至
然后再加入适当物质调整溶液至![]() ,使
,使![]() 转化为
转化为![]() ,调整溶液pH可选用下列中的 ______ .
,调整溶液pH可选用下列中的 ______ .
A.NaOH ![]()
![]()
![]()
(2)在![]() 下,向浓度均为
下,向浓度均为![]() 的
的![]() 和
和![]() 混合溶液中逐滴加入氨水,先生成 ______ 沉淀
混合溶液中逐滴加入氨水,先生成 ______ 沉淀![]() 填化学式
填化学式![]() ,生成该沉淀的离子方程式为 ______
,生成该沉淀的离子方程式为 ______ ![]() 已知
已知![]() 时
时![]() .
.
(3)向![]() 溶液中加入
溶液中加入![]() 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时, ![]() ______
______ ![]()
(4)向盛有1mL![]() 溶液的试管中滴加2滴
溶液的试管中滴加2滴![]() NaOH溶液,有白色沉淀生成,再滴加2滴
NaOH溶液,有白色沉淀生成,再滴加2滴![]() 溶液,静置
溶液,静置![]() 可以观察到的现象是 ______ ,产生该现象的原因是
可以观察到的现象是 ______ ,产生该现象的原因是![]() 用离子方程式表示
用离子方程式表示![]() ______ 已知:Ksp[
______ 已知:Ksp[![]() ]=4.0x10-38。
]=4.0x10-38。
【答案】 B CD ![]()
![]()
![]() 白色沉淀转化为红褐色沉淀
白色沉淀转化为红褐色沉淀 ![]()
【解析】本题主要考查沉淀溶解平衡.
(1)①在提纯时为了除去![]() ,常加入合适氧化剂,使
,常加入合适氧化剂,使![]() 氧化为
氧化为![]() ,下列物质最好选用的是B ,ACD会产生杂质离子.
,下列物质最好选用的是B ,ACD会产生杂质离子.
![]() 然后再加入适当物质调整溶液至
然后再加入适当物质调整溶液至![]() ,使
,使![]() 转化为
转化为![]() ,调整溶液pH可选用下列中的CD,AB会产生杂质离子.
,调整溶液pH可选用下列中的CD,AB会产生杂质离子.
(2)在![]() 下,向浓度均为
下,向浓度均为![]() 的
的![]() 和
和![]() 混合溶液中逐滴加入氨水,开始生成
混合溶液中逐滴加入氨水,开始生成![]() 需要的c(OH-)较小,所以先生成
需要的c(OH-)较小,所以先生成![]() 沉淀,生成该沉淀的离子方程式为
沉淀,生成该沉淀的离子方程式为![]() .
.
(3)向![]() 溶液中加入
溶液中加入![]() 和KBr,当两种沉淀共存时,
和KBr,当两种沉淀共存时, ![]()
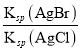 =
= ![]() .
.
(4)向盛有1mL![]() 溶液的试管中滴加2滴
溶液的试管中滴加2滴![]() NaOH溶液,有白色沉淀生成,再滴加2滴
NaOH溶液,有白色沉淀生成,再滴加2滴![]() 溶液,静置
溶液,静置![]() 可以观察到的现象是白色沉淀转化为红褐色沉淀,产生该现象的原因是
可以观察到的现象是白色沉淀转化为红褐色沉淀,产生该现象的原因是![]() .
.


 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,实验室合成硫酰氯的实验装置如下图所示:

已知:① SO2(g) + Cl2(g)![]() SO2Cl2(l) △H = -97.3 kJ/mol;
SO2Cl2(l) △H = -97.3 kJ/mol;
② 硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂为______________。装置丙中活性炭的作用是______________。
(2)在上图方框内画出所缺装置,并注明相关试剂的名称。
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_____________,分离产物的方法是(填字母)_________。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
① 先通冷凝水,再通气 ② 控制气流速率,宜慢不宜快
③ 若三颈烧瓶发烫,可适当降温 ④ 加热三颈烧瓶
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计 一个简单实验验证二者是否恰好完全反应: (简要描述实验步骤、现象和结论)。
仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、碘化钾溶液、淀粉溶液、品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天宫二号空间实验室已于2016 年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:

(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是______(填化学式),该物质的类别属于________(填“碱性氧化物”或“酸性氧化物”) ,实验室中不能用玻璃塞试剂瓶盛放KOH溶液,原因是_______________(用离子方程式表示)
(2)“碳纤维复合材料制品”应用于“天宫二号”的推进系统。碳纤维复合材料具有重量轻、可设计强度高的特点。碳纤维复合材料由碳纤维和合成树脂组成,其中合成树脂是高分子化合物,则制备合成树脂的反应类型是_____________。
(3)太阳能电池帆板是“天宫二号”空间运行的动力源泉,其性能直接影响到“天宫二号”的运行寿命和可靠性。
① 天宫二号使用的光伏太阳能电池,该电池的核心材料是_____,其能量转化方式为_____。
② 下图是一种全天候太阳能电池的工作原理:
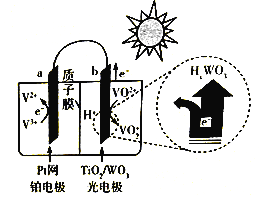
太阳照射时的总反应为V3++ VO2++ H2O=V2++VO2++2H+,则负极反应式为__________;夜间时,电池正极为______(填“a”或“b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉煤气为炼铁过程中产生的副产品,主要成分为N2、CO、CO2、H2O等,其中可燃成分CO含量约占25%左右,CO2、N2的含量分别占15%、55%。回答下列问题:
(1)上述提及的气体分子中,电子数相等的两种气体是________(写化学式)。
(2)高炉煤气中CO具有较高的利用价值,可以与H2合成甲烷,已知有关反应的热化学方程式如下:
① H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol
O2(g)=H2O(l) △H=-285.8kJ/mol
② CO(g)+![]() O2(g)=CO2(g) △H=-283.0kJ/mol
O2(g)=CO2(g) △H=-283.0kJ/mol
③CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ/mol
则CO(g)+2H2(g)=CH4(g)+ ![]() O2(g) △H=_________kJ/mol。
O2(g) △H=_________kJ/mol。
(3)高炉煤气中N2的含量较高,利用CO前需要对CO 进行富集,实现CO和N2的分离。
① 工业上常采用醋酸亚铜氨溶液来吸收CO,该反应的热化学方程式为
CH3COOCu(NH3)2(aq)+CO(g)=CH3COOCu(NH3)2·CO(aq) △H<0。吸收CO后的溶液经过适当处理可恢复为醋酸亚铜氨溶液,从而实现CO与吸收液的分离,分离过程可采取的措施有______________(写出一种即可)。
②到目前为止,CO吸附剂的开发大多数以亚铜为活性组分负载在各种载体上,然后采用变压吸附(PSA)方式在含N2体系中脱出CO。下图是变压吸附回收高炉煤气中CO的流程图:
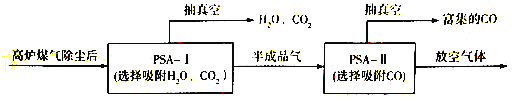
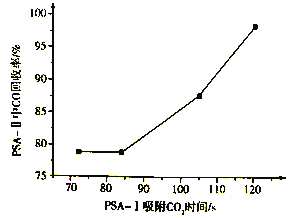
PSA-I吸附CO2时间对PSA-II中CO回收率的影响见下图,由此可见,为了保证载体亚铜吸附剂对CO的吸附和提纯要求,应采取的措施是________, “放空气体”的主要成分为_______。
(4)高炉炼铁过程中发生的主要反应为Fe2O3(s)+ 3 CO(g)===2Fe (s)+3CO2(g)。该反应在不同温度下的平衡常数如下表所示:
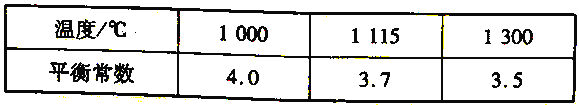
① 该反应的△H______0(填“> " " < ”或“= " )。
② 欲提高上述反应中CO 的转化率,可采取的措施是______。
a.适当降低反应体系的温度 b.及时移出体系中的CO2 c.加入合适的催化剂
d.减小容器的容积 e.增大Fe2O3的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是食品加工中最为快捷的食品添加剂,用于焙烤食品;
是食品加工中最为快捷的食品添加剂,用于焙烤食品; ![]() 在分析试剂、医药、电子工业中用途广泛
在分析试剂、医药、电子工业中用途广泛![]() 请回答下列问题:
请回答下列问题:
(1)![]() 可作净水剂,其原理是 ______
可作净水剂,其原理是 ______ ![]() 用必要的化学用语和相关文字说明
用必要的化学用语和相关文字说明![]() .
.
(2)相同条件下, ![]() 的
的![]() 中
中![]() ______
______ ![]() 填“等于”、“大于”或“小于”
填“等于”、“大于”或“小于”![]() 中
中![]()
(3)均为![]() 的几种电解质溶液的pH随温度变化的曲线如图1所示.
的几种电解质溶液的pH随温度变化的曲线如图1所示.
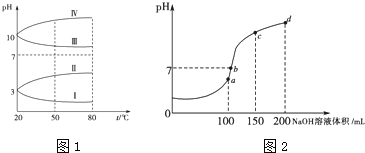
①其中符合![]()
![]() 的pH随温度变化的曲线是 ______ ,导致pH随温度变化的原因是 ______ ;
的pH随温度变化的曲线是 ______ ,导致pH随温度变化的原因是 ______ ;
②![]() 时,
时, ![]() 的
的![]()
![]() 中
中![]() ___ mol/L
___ mol/L
(4)室温时,向100mL![]() 溶液中滴加
溶液中滴加![]() 溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是 ______ .
溶液,溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 ______ 点;在b点,溶液中各离子浓度由大到小的排列顺序是 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其它相关物质可能省略)下列说法不正确的是( )
![]()
A. 若A为非金属单质,则D一定为硝酸或硫酸
B. 若A为金属单质,则组成A的元素一定位于第三周期第IA族
C. 不论A为单质还是化合物,D都有可能是同一种物质,该物质的浓溶液在常温下能使铁和铝发生钝化
D. 若A是共价化含物,A的水溶液一定显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油酸甘油酯(相对分子质量884)是一种典型的脂肪,在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)。已知要消耗1kg该化合物,常人需快走约200公里(每快走1公里按平均耗能190 kJ计)。则油酸甘油酯的燃烧热△H约为( )
A. 3.8×104kJ·mol-1 B. -3.8×104kJ·mol-1
C. 3.4×104kJ·mol-1 D. -3.4×104kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe3++SO32-+H2O![]() 2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是
2Fe2++SO42-+2H+。如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计,其指针总是偏向电源负极。A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是

A.G的指针指向B极
B.U中阳离子向A极移动
C.一段时间后,化学反应达到平衡状态,导线中无电流通过
D.一段时间后,B中溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图示是由3个圆所构成的类别关系图,其中I为大圆,II和III分别为大圆之内的小圆。下列选项中符合这种类别关系的是( )

A. I: DNA II: RNA III:核酸
B. I:还原性糖 II:果糖 III:蔗糖
C. I:固醇 II:胆固醇 III:维生素D
D. I:蛋白质 II:酶 III:激素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com