
| A. | 稀有气体化学性质很稳定 | B. | 硝酸易挥发,而硫酸难挥发 | ||
| C. | 氮气的化学性质比氧气稳定 | D. | 常温常压下,溴呈液态,碘呈固态 |
分析 键能的大小代表化学键的稳定性的高低,键能越大,化学键越牢固,化学性质越稳定,因此用键能可以解释物质化学性质的稳定性,
A.稀有气体的原子最外层(氦2电子稳定结构)达到了8电子稳定结构,与键能无关;
B.硝酸和硫酸的挥发性与它们的分子间作用力有关;
C.氮氮三键键能较大,属于氮气的化学性质稳定;
D.常温常压下,溴和碘的聚集状态与分子间作用力有关,与化学键无关.
解答 解:A.稀有气体属于单原子分子,不含有化学键,因此不能用键能解释,故A错误;
B.物质的挥发性属于物理性质,键能的大小与化学性质的稳定性有关,与其物理性质无关,故B错误;
C.氮氮三键的键能大于氧气中氧氧键的键能,氮氮三键更牢固,因此氮气化学性质稳定,故C正确;
D.常温常压下,溴分子与溴分子间存在分子间作用力,碘分子与碘分子间存在分子间作用力,分子间作用力的大小,决定物质的聚集状态是气态、液态、还是固态,与化学键无关,故不能用键能大小解释,故D错误;
故选C.
点评 本题考查物质组成、结构与性质的关系,涉及物质熔沸点的判断、分子的化学键构成等知识,题目难度不大,A选项中稀有气体没有化学键这一点容易忽略,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Ca(OH)2+CO2=CaCO3↓+H2O | B. | CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO | ||
| C. | 2Fe2O3+3C$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑ | D. | CO+H2O$\frac{\underline{\;\;△\;\;}}{\;}$H2+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,8.0gSO3体积为2.24L | |
| B. | 物质的量为1molSO2、CO2的混合物所含氧原子数为2NA | |
| C. | 0.1molFeCl3溶液中含有的Fe3+数为0.1NA | |
| D. | 0.5mol镁在空气中完全燃烧所需要的氧气的物质的量为0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.4g丙烷含有碳氢键的数目为NA | |
| B. | 3.9gNa2O2与足量CO2反应转移的电子数为0.1NA | |
| C. | 标准状况下,11.2LH2O中含有的分子数为0.5NA | |
| D. | 9.2gNO2和N2O4的混合气体中含有的氮原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
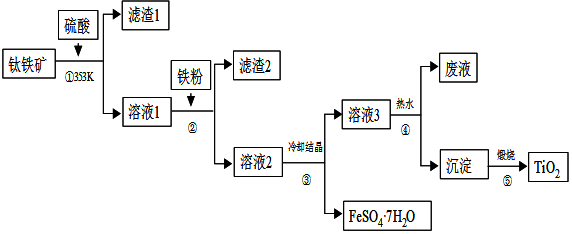
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 现象 | 由现象所得结论 |
| A | 将Cl2通入品红溶液 | 品红褪色 | Cl2具有漂白性 |
| B | 分别测量饱和NaCO3、饱和NaHCO3溶液的pH | pH值:碳酸钠>碳酸氢钠 | 水解能力:CO32->HCO3- |
| C | 将CO2通入CaCl2的溶液中 | 无明显现象 | 酸性:盐酸>碳酸 |
| D | 观察铁块、铝箔在潮湿空气中的腐蚀情况 | 铁块生锈,而铝箔几乎无变化 | 在潮湿空气中铁比铝要活泼 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
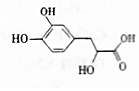 丹参素可用于祛瘀止痛、凉血消痈、养血安神.其结构简式如图.
丹参素可用于祛瘀止痛、凉血消痈、养血安神.其结构简式如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com