
二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}制备流程如下:
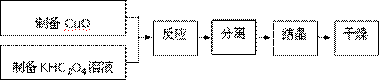
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤。
①过滤所需的玻璃仪器有
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净
(2)①为提高CuO的利用率,让滤纸上的CuO充分转移到热的KHC2O4溶液中,以下方案正确的是
a.剪碎滤纸,加入到热的KHC2O4溶液中,待充分反应后趁热过滤
b.用稀硫酸溶解滤纸上的氧化铜,然后将溶液转入热的KHC2O4溶液中
c.用氢氧化钾溶液溶解氧化铜,并转入热的KHC2O4溶液中
d.在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液
②50℃水浴加热至反应充分,发生反应的化学方程式为 ;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体。
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,此反应进行的主要原因是 。
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗; b. 。
②在蒸发浓缩的初始阶段还采用了蒸馏的操作,其目的是 。
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
冶炼金属一般有下列四种方法: ① 焦炭法;② 水煤气(或H2、CO)法;③ 活泼金属置换法;④ 电解法。这四种方法在工业上均有应用。古代有: (Ⅰ) 火烧孔雀石炼铜;(Ⅱ) 湿法炼铜。现代有: (Ⅲ) 铝热法炼铬;(Ⅳ) 从光卤石中炼镁。对它们的冶炼方法的分析中不正确的是(B)
A. (Ⅰ), ①
B. (Ⅱ),②
C. (Ⅲ),③
D. (Ⅳ),④
查看答案和解析>>
科目:高中化学 来源: 题型:
羧酸酯RCOOR′在催化剂存在时可与醇R″OH发生如下反应(R′、R″是两种不同的烃基):
RCOOR′+R″—OH RCOOR″+R′—OH
RCOOR″+R′—OH
此反应称为酯交换反应,常用于有机合成。广泛用于婴儿“尿不湿”等吸水产品的聚乙烯醇就是利用这一原理生产的:用聚乙酸乙烯酯与过量甲醇在一定条件下反应,可得聚乙烯醇和乙醇甲酯。
(1)反应中甲醇为什么要过量?
________________________________________________________________________
________________________________________________________________________。
(2)写出聚乙酸乙烯酯与甲醇进行酯交换反应的化学方程式:
_______________________________________________________________________
________________________________________________________________________。
(3)酯交换反应也可用于从废弃的涤纶树脂(聚对苯二甲酸乙二醇酯,结构简式为
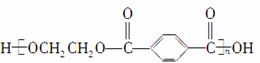 )中回收其单体以用于树脂的再合成。写出用过量的甲醇处理废弃涤纶树脂过程中反应的化学方程式。
)中回收其单体以用于树脂的再合成。写出用过量的甲醇处理废弃涤纶树脂过程中反应的化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室从含溴化氢的废液中提取溴单质,下列说法中能达到实验目的的是
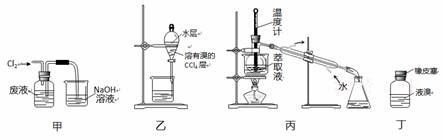
A.用装置甲氧化废液中的溴化氢 B.用装置乙分离油层和水层
C.用装置丙分离四氯化碳和液溴 D.用仪器丁密封存放单质溴
查看答案和解析>>
科目:高中化学 来源: 题型:
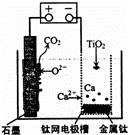
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2﹣CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中正确的是( )
|
| A. | 将熔融CaF2﹣CaO换成Ca(NO3)2溶液也可以达到相同目的 |
|
| B. | 阳极的电极反应式为:C+2O2﹣﹣4e﹣═CO2↑ |
|
| C. | 在制备金属钛前后,整套装置中CaO的总量减少 |
|
| D. | 若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)汽车发动机工作时会引发N2和O2反应,生成NOx等污染大气.其中生成NO的能量变化示意图如图1:
①该反应的热化学方程式为
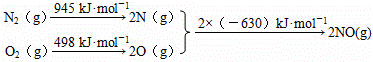 N2(g)+O2(g)=2NO(g)△H=+184kJ•mol﹣1 .
N2(g)+O2(g)=2NO(g)△H=+184kJ•mol﹣1 .
②根据图1所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K AC .
A.可能增大 B.一定不变 C.可能不变 D.可能减小 E.增大、减小、不变均有可能
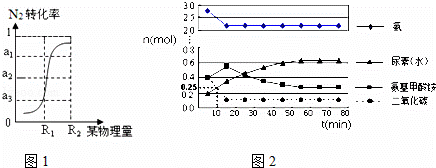
(2)尿素(又称碳酰胺)是含氮量最高的氮肥,工业上利用CO2和NH3在一定条件下合成尿素的反应分为:
第一步:2NH3(g)+CO2(g)⇌H2NCOONH4(氨基甲酸铵) (l)
第二步:H2NCOONH4(l)⇌H2O(g)+H2NCONH2(l)
某实验小组模拟工业上合成尿素的条件,在一体积为500L的密闭容器中投入4mol氨和1mol二氧化碳,验测得
反应中各组分的物质的量随时间的变化如图2所示:
①合成尿素总反应的快慢由第 二 步反应决定.
②反应进行到10min时测得CO2的物质的量如上图所示,则用CO2表示的第一步反应的速率v(CO2)= 1.5×10﹣4 mol/(L•min).
③由氨基甲酸铵和CO2曲线变化可得出关于浓度变化和平衡状态的两条结论是:a. 氨基甲酸铵浓度先增大,15min后减小 ;b 15min时第一步反应达到平衡状态,55min第二步反应达到平衡状态 .
查看答案和解析>>
科目:高中化学 来源: 题型:
化学卷·2015届浙江省嘉兴市高三上学期学科基础测试(201409)】30.(本题10分)实验室从含碘废液(除H2O外,含有CCl4, I2, I-等)中回收碘,其实验过程如下:

(1)操作x的名称为________________。主要的仪器是_______________________。
(2)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的 I2 还原为I-,其离子方程式为_________;该操作的目的是____________________。
(3)①在测定亚硫酸钠溶液浓度时,量取25.00mL亚硫酸钠溶液,用0.10mol·L-1的酸性高锰酸钾溶液进行滴定,下列说法正确的是_________________。
A.润洗滴定管时,应从滴定管上口加满所需的试液,使滴定管内壁充分润洗
B.高锰酸钾溶液装在酸式滴定管中,本实验无需外加指示剂
C.滴定时,眼睛注视滴定管中液面的变化
D.滴定开始时读数正确,滴定终点仰视读数,会使实验误差偏高
②达到滴定终点时,消耗高锰酸钾溶液18.00mL,则亚硫酸钠溶液的浓度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
可以判断油脂皂化反应基本完成的现象是( )
A.反应液使红色石蕊试纸变蓝色
B.反应液使蓝色石蕊试纸变红色
C.反应后静置,反应液分为两层
D.反应后静置,反应液不分层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com