
分析 ①原子半径小于阴离子半径,原子半径大于阳离子半径;
②元素的非金属性越强,其氢化物的稳定性越强;
③元素的非金属性越强,其简单阴离子的还原性越弱;
④元素的非金属性越弱,其氢化物的还原性越强;
⑤元素的非金属性越强,其最高价氧化物的水化物酸性越强;
⑥同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素其非金属性随着原子序数增大而减弱;
⑦同一周期元素,元素金属性随着原子序数增大而减弱,同一主族元素其金属性随着原子序数增大而增强;
⑧分子晶体熔沸点与其相对分子质量成正比,含有氢键的氢化物熔沸点较高;
⑨mXa+与nYb-核外电子排布相同,得m-a=n+b.
解答 解:①原子半径小于阴离子半径,原子半径大于阳离子半径,所以S2->S,故正确;
②元素的非金属性越强,其氢化物的稳定性越强,非金属性F>S>Si,所以氢化物的稳定性:HF>H2S>SiH4,故正确;
③元素的非金属性越强,其简单阴离子的还原性越弱,非金属性Cl>Br>I>S,所以离子的还原性:Cl-<Br-<I-<S2-,故错误;
④元素的非金属性越弱,其氢化物的还原性越强,非金属性F>Cl>S,所以还原性:HF<HCl<H2S,故错误;
⑤元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性S>P>C,所以酸性:H2SO4>H3PO4>H2CO3,次氯酸酸性很弱其酸性小于碳酸,所以酸性:H2SO4>H3PO4>H2CO3>HClO,故正确;
⑥同一周期元素,元素非金属性随着原子序数增大而增强,同一主族元素其非金属性随着原子序数增大而减弱,所以非金属性O>N>P>Si,故正确;
⑦同一周期元素,元素金属性随着原子序数增大而减弱,同一主族元素其金属性随着原子序数增大而增强,所以金属性:Be<Mg<Ca<K,故正确;
⑧分子晶体熔沸点与其相对分子质量成正比,含有氢键的氢化物熔沸点较高,所以沸点NH3>AsH3>PH3,故错误;
⑨mXa+与nYb-核外电子排布相同,得m-a=n+b,故错误;
故选③④⑧⑨.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素性质、结构递变规律是解本题关键,注意规律中的反常现象,注意氢化物的稳定性与化学键有关,但其熔沸点与分子间作用力有关,为易错点.


科目:高中化学 来源: 题型:解答题
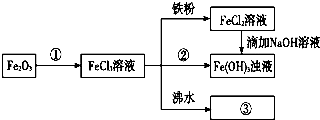
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1=1mol•L-1 | B. | 2c1>c2 | C. | 2ω1<ω2 | D. | $\frac{{c}_{1}}{{ω}_{1}}$<$\frac{{c}_{2}}{{ω}_{2}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
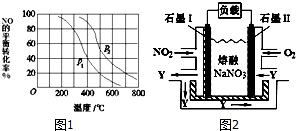
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L的AlCl3 | B. | 75mL 2mol/L的Al(NO3)3 | ||
| C. | 50mL 3mol/L的AlCl3 | D. | 50mL 3mol/L的AlBr3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 淀粉、油脂、蛋白质等天然高分子化合物都可以水解 | |
| B. | 某容器内的物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 | |
| C. | 江河入海口三角洲的形成通常与胶体的性质有关 | |
| D. | 质子数为53,中子数为78的点原子可以表达为:${\;}_{53}^{78}$I |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
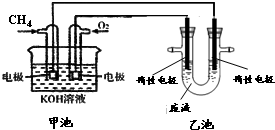 氯化铁溶液常作印刷电路铜板的腐蚀剂,得 到含有Cu2+等的废液,有人提出可以利用如图的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为1.12L(假设气体全部逸出).
氯化铁溶液常作印刷电路铜板的腐蚀剂,得 到含有Cu2+等的废液,有人提出可以利用如图的装置从得到的废液中提炼金属铜.该过程中甲池负极的电极反应式是CH4+10OH--8e-=CO32-+7H2O,若乙池中装入废液500mL,当阴极增重3.2g时,停止通电,此时阳极产生气体的体积(标准状况)为1.12L(假设气体全部逸出).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚遇石蕊显红色 | B. | 食用花生油能发生水解反应 | ||
| C. | 包装用材料聚氯乙烯属于烃 | D. | PX项目中的对二甲苯属于饱和烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com