
| 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 物质 | Na2O | NaCl | AlF3 | AlCl3 | BCl3 | Al2O3 | NO2 | SiO2 |
| 熔点℃ | 920 | 801 | 1291 | 190 | -107 | 2073 | -93 | 1723 |
| c(N2O4) |
| c2(NO2) |
 ;SiO2为原子晶体,1个硅原子与4个氧原子形成正四面题,键角为109°28′;
;SiO2为原子晶体,1个硅原子与4个氧原子形成正四面题,键角为109°28′; ;109°28′;
;109°28′;
| ||
| ||
| c(N2O4) |
| c2(NO2) |


科目:高中化学 来源: 题型:
A、苯酚钠溶液中通入少量CO2: -O-+CO2+H2O→ -O-+CO2+H2O→ -OH+HCO3- -OH+HCO3- | ||
| B、硫化钠的水解:S2-+2H2O?H2S+2OH- | ||
C、醋酸钡溶液和硫酸反应:Ba2++S
| ||
| D、氢氧化钙溶液和碳酸氢镁反应:Ca2++OH-+HCO3-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | - 4 |
| O | 3- 4 |
| O | 2- 4 |
| O | 2- 3 |
| O | - 3 |
| O | - 2 |
| O | 2- 3 |
| O | - 3 |
| O | - 3 |
| H | + 4 |
| O | 2- 3 |
| H | + 4 |
| O | 2- 4 |
| O | - 4 |
| O | - 3 |
| O | 2- 4 |
| O | - 3 |
| A、①③ | B、②④⑤ |
| C、①②⑤ | D、③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )
反应mA(s)+nB(g)?eC(g)+fD(g)反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如图,下列叙述正确的是( )| A、达到平衡后,加入催化剂,则C%增大 |
| B、该反应的△S<0,△H<0 |
| C、化学方程式中n<e+f |
| D、达到平衡后,增加A的量有利于平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AgCl悬浊液中加入KI溶液:Ag++I-=AgI↓ |
| B、向Ba(OH)2溶液中滴加少量CuSO4溶液:Ba2++SO42-=BaSO4↓ |
| C、向Ca(HCO3)2溶液中滴加少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、向NaClO的碱性溶液中滴加少量CoCl2生成Co(OH)3沉淀:2Co2++ClO-+5H2O=2Co(OH)3↓+Cl-+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
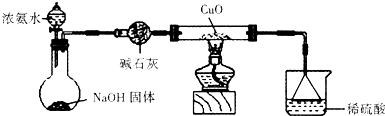
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 8 |
| O | 2- 7 |
| O | 2- 4 |
2- 7 |
| O | 2- 8 |
| O | 2- 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.8g重水(D2O)中含有的质子数和电子数均为1.ONA | |||||||||
B、500℃、30MPa下,N2(g)+3H2(g)
| |||||||||
| C、标准状况下,将11.2 LCl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA | |||||||||
| D、15g石英晶体中含有的Si-O键数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com