
某学生设计的用氨催化法制取少量HNO3溶液的实验装置如图所示: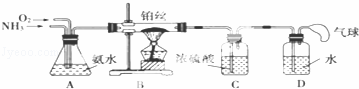
(1)实验室制备NH3,下列方法中适宜选用的是 (填序号).
①固态氯化铵与熟石灰混合加热
②固态氯化铵加热分解
③碱石灰中滴加浓氨水
④氯化铵溶液与氢氧化钠溶液共热
(2)装置B中发生反应的化学方程式为 .在实验过程中,加热铂丝红热后,移去酒精灯,发现铂丝还继续保持红热,由此可判断该反应是 (填“吸热”或“放热”)反应.
(3)装置C的作用是 ;装置C中的现象是 ;为确保装置D中尽可能多地生成HNO3,所通入O2和NH3的体积比应大于 .
(4)装置D中发生的反应方程式为 .
考点: 氨的制取和性质.
专题: 实验题.
分析: (1)氯化铵加热生成氨气和氯化氢,氯化氢和氨气反应生成氯化铵;氨气易溶于水,稀氨水浓度小,不能制氨气;氯化铵溶液与氢氧化钠溶液共热,能制得氨气但量少,不是实验室制备氨气的方法;实验室用固态氯化铵与氢氧化钙混合加热制备氨气和碱石灰中滴加浓氨水方法制氨气;
(2)氨催化氧化生成一氧化氮和水;移去酒精灯,发现铂丝还继续保持红热,说明反应是放热反应;
(3)装置C浓硫酸的作用是吸收未反应的NH3,装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3,其含义就是NH3通过转化后全部生成HNO3,由4NH3+5O2 4NO+6H2O及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1;
4NO+6H2O及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1;
(4)NO2与H2O反应,生成硝酸和一氧化氮.
解答: 解:(1)①固态氯化铵与熟石灰混合加热,是实验室制氨气的主要方法,故正确;
②固态氯化铵加热分解,成氨气和氯化氢,氯化氢和氨气反应生成氯化铵,故错误;
③碱石灰中滴加浓氨水,也是实验室制氨气的方法之一,故正确;
④氯化铵溶液与氢氧化钠溶液共热,能制得氨气但量少,不是实验室制备氨气的方法;
故选:①③;
(2)氨催化氧化生成一氧化氮和水,方程式为:4NH3+5O2 4NO+6H2O,移去酒精灯,发现铂丝还继续保持红热,说明反应是放热反应,
4NO+6H2O,移去酒精灯,发现铂丝还继续保持红热,说明反应是放热反应,
故答案为:4NH3+5O2 4NO+6H2O;放热;
4NO+6H2O;放热;
(3)装置C浓硫酸的作用是吸收未反应的NH3,装置B中产生的NO通过浓硫酸时,可看到浓硫酸中有气泡冒出,同时NO在装置C的上部与O2迅速反应生成红棕色的NO2;为确保装置D中尽可能多地生成HNO3,其含义就是NH3通过转化后全部生成HNO3,由4NH3+5O2 4NO+6H2O及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1,
4NO+6H2O及4NO+3O2+2H2O=4HNO3可得:NH3+2O2=HNO3+H2O,由此可见通入O2和NH3的体积比应大于2:1,
故答案为:吸收未反应的NH3;有气泡从浓硫酸中冒出,且装置C内的上部呈红棕色;2:1;
(4)NO2与H2O反应,生成硝酸和一氧化氮,方程式为:3NO2+H2O═2HNO3+NO,故答案为:3NO2+H2O═2HNO3+NO.
点评: 本题是实验室氨气的制备装置和浓硫酸的性质应用,掌握氨气的制备和性质以及掌握氨的催化氧化反应和一氧化氮转化为硝酸的原理是解答的关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中均发生如下反应:
2SO2(g)+O2(g)⇌2SO3(g)+197kJ
实验测得有关数据如表:
容器编号 起始时各物质的物质的量/mol 达到平衡时体系能量的变化/KJ
SO2 O2 SO3
甲 2 1 0 Q1
乙 1.8 0.9 0.2 Q2
丙 0 0 2 Q3
下列判断中正确的是()
A. 197>Q2>Q1
B. 若升高温度,反应的热效应不变
C. Q3=﹣197kJ
D. 生成1mol SO3(l)时放出的热量大于98.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl﹣、Mg2+、Ba2+、CO32﹣、SO42﹣,现取三份100mL溶液进行下列实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到0.04mol气体;
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g;根据上述实验,推测100mL该溶液中一定存在的离子以及计算这些离子的物质的量.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol﹣1、1411.0kJ•mol﹣1和1366.8kJ•mol﹣1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为()
A. ﹣44.2 kJ•mol﹣1 B. +44.2 kJ•mol﹣1
C. ﹣330 kJ•mol﹣1 D. +330 kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:3NO2+2NaOH→NaNO3+NaNO2+H2O;NO2+NO+2NaOH→2NaNO2+H2O).现有由amolNO、bmolNO2、cmolN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为()
A.  mol•L﹣1 B.
mol•L﹣1 B. 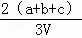 mol•L﹣1
mol•L﹣1
C. 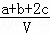 mol•L﹣1 D.
mol•L﹣1 D.  mol•L﹣1
mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
|
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
|
| B. | 元素由化合态变为游离态的反应一定是还原反应 |
|
| C. | 置换反应一定是氧化还原反应 |
|
| D. | 失电子难的原子,一定容易得电子,反之成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | Na2O2是碱性氧化物,能与盐酸反应生成盐 |
|
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 |
|
| C. | 检测某溶液是否含有 |
|
| D. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
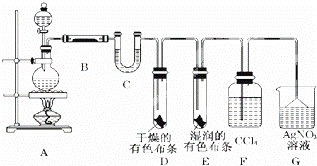
(1)写出实验室制备氯气的离子方程式
(2)①图中滴加浓盐酸的装置名称
②装置B中盛放的试剂名称为 ,
③装置D和E中出现的不同现象说明的问题是
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,乙同学提出在某两个装置之间再加一个装置.你认为该装置中应放入 (填写试剂或用品名称).
(4)漂白粉在空气中长期放置失效的化学方程式
(5)该兴趣小组用100mL 12mol/L盐酸与 8.7gMnO2制备氯气,并将所得氯气与过量的石灰乳反应,则理论上最多可制得 g漂白粉.
查看答案和解析>>
科目:高中化学 来源: 题型:
小红在帮实验员整理化学试剂时,发现一瓶标签破损的无色溶液,标签严重破损,只能隐约看到一部分(如图).下列说法不正确的是( )

|
| A. | 该有机物肯定是甲酸乙酯,能发生银镜反应 |
|
| B. | 该有机物的分子式为C3H6O2 |
|
| C. | 在酸性条件下水解生成两种有机产物的相对分子质量可能相等 |
|
| D. | 在碱性条件下可完全水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com