
| ŹµŃé ŠņŗÅ | Ģ¼ĖįøĘ ×“Ģ¬ | c£ØHCl£© /mol•L-1 | ČÜŅŗĪĀ¶Č/”ę | Ģ¼ĖįøĘĻūŹ§ Ź±¼ä/s | |
| ·“Ó¦Ē° | ·“Ó¦ŗó | ||||
| 1 | Į£×“ | 0.5 | 20 | 39 | 400 |
| 2 | ·ŪÄ© | 0.5 | 20 | 40 | 60 |
| 3 | Į£×“ | 0.6 | 20 | 41 | 280 |
| 4 | Į£×“ | 0.8 | 20 | 40 | 200 |
| 5 | ·ŪÄ© | 0.8 | 20 | 40 | 30 |
| 6 | Į£×“ | 1.0 | 20 | 40 | 120 |
| 7 | Į£×“ | 1.0 | 30 | 50 | 40 |
| 8 | Į£×“ | 1.2 | 20 | 40 | 90 |
| 9 | Į£×“ | 1.2 | 25 | 45 | 40 |
·ÖĪö £Ø1£©Ķعż±ķÖŠŹż¾Ż£¬¶Ō±Č·“Ó¦Ē°ŗóĪĀ¶Č±ä»ÆæÉÖŖøĆ·“Ó¦·ÅČČ£»
£Ø2£©ÓÉŹµŃé6ŗĶ7ŹµŃ鏿¾ŻæÉÖŖ£¬ĘäĖūĢõ¼žĻąĶ¬£¬ĪĀ¶ČŌ½øߣ¬Ģ¼ĖįøĘĻūŹ§µÄĖłÓĆŹ±¼äŌ½ÉŁ£»
£Ø3£©ŹµŃé1”¢3”¢4”¢6”¢8ĘäĖūĢõ¼žĻąĶ¬£¬·“Ó¦ĪļµÄÅضČŅĄ“ĪŌö“ó£¬Ģ¼ĖįøĘĻūŹ§µÄĖłÓĆŹ±¼äŅĄ“Ī¼õÉŁ£¬ĖµĆ÷·“Ó¦ĪļÅضČŌ½“󣬷“Ó¦ĖŁĀŹŌ½æģ£»
£Ø4£©ŹµŃé1”¢2ÖŠÖ»ÓŠ¹ĢĢåµÄŠĪד²»Ķ¬£¬ŹµŃ鏿¾Ż±ķĆ÷·ŪÄ©Ź±µÄ·“Ó¦ĖŁĀŹ“óÓŚĮ£×“£¬ŌņæÉĖµĆ÷½Ó“„Ć껿Ō½“󣬷“Ó¦ĖŁĀŹŌ½“ó£®
½ā“š ½ā£ŗ£Ø1£©Ķعż±ķÖŠŹż¾Ż£¬¶Ō±Č·“Ó¦Ē°ŗóĪĀ¶Č±ä»ÆæÉÖŖ£¬·“Ó¦ŗóČÜŅŗĪĀ¶ČÉżøߣ¬Ōņ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬
¹Ź“š°øĪŖ£ŗ·ÅČČ£»
£Ø2£©ÓÉŹµŃé6ŗĶ7ŹµŃ鏿¾ŻæÉÖŖ£¬ĘäĖūĢõ¼žĻąĶ¬Ź±£¬ĪĀ¶ČŌ½øߣ¬Ģ¼ĖįøĘĻūŹ§µÄĖłÓĆŹ±¼äŌ½ÉŁ£¬ĖµĆ÷ĪĀ¶ČŌ½øߣ¬·“Ó¦ĖŁĀŹŌ½“ó£»ŹµŃé8ŗĶ9µÄĘäĖūĢõ¼žĻąĶ¬£¬·“Ó¦ĪĀ¶ČŌ½øߣ¬Ģ¼ĖįøĘĻūŹ§µÄĖłÓĆŹ±¼äŌ½ÉŁ£¬
¹Ź“š°øĪŖ£ŗĪĀ¶Č£»ĪĀ¶ČŌ½øߣ»8ŗĶ9£»
£Ø3£©ŹµŃé1”¢3”¢4”¢6”¢8ĻąĶ¬µÄµŲ·½ŹĒ¹ĢĢåµÄŠĪדĻąĶ¬£¬·“Ó¦Ē°µÄĪĀ¶ČĻąĶ¬£¬µ«·“Ó¦ĪļµÄÅضČŅĄ“ĪŌö“ó£¬Ģ¼ĖįøĘĻūŹ§µÄĖłÓĆŹ±¼äŅĄ“Ī¼õÉŁ£¬ĖµĆ÷·“Ó¦ĪļÅضČŌ½“󣬷“Ó¦ĖŁĀŹŌ½æģ£¬
¹Ź“š°øĪŖ£ŗĘäĖüĢõ¼žŅ»¶Ø£¬·“Ó¦ĪļÅضČŌ½“󣬷“Ó¦ĖŁĀŹŌ½æģ£»
£Ø4£©ŹµŃé1”¢2Źż¾Ż·“Ó¦ĪĀ¶ČĻąĶ¬£¬ŃĪĖįµÄÅضČĻąĶ¬£¬µ«¹ĢĢåµÄŠĪד²»Ķ¬£¬ŹµŃ鏿¾Ż±ķĆ÷·ŪÄ©Ź±µÄ·“Ó¦ĖŁĀŹ“óÓŚĮ£×“£¬ŌņæÉĖµĆ÷½Ó“„Ć껿Ō½“󣬷“Ó¦ĖŁĀŹŌ½“ó£¬ŹµŃé4ŗĶ5ÖŠµÄŹż¾ŻÖ»ÓŠ½Ó“„Ć껿²»Ķ¬£¬ĘäĖūĢõ¼žĻąĶ¬£¬·Ūĩד±ČĮ£×“·“Ó¦ĖŁĀŹæģ£¬
¹Ź“š°øĪŖ£ŗ·“Ó¦ĪļµÄ½Ó“„Ć껿£»4ŗĶ5£®
µćĘĄ ±¾Ģāæ¼²éĮĖĶā½ēĢõ¼ž¶Ō·“Ó¦ĖŁĀŹÓ°ĻģµÄŹµŃéĢ½¾æ£¬æŲÖʱäĮæ·ØµÄ·ÖĪöŹĒ½ā±¾ĢāµÄ¹Ų¼ü£¬ĢāÄæÄѶȏŹÖŠ£¬×¢ŅāÅąŃų¶ŌĶ¼±ķŹż¾ŻµÄ·ÖĪöÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | XŌŖĖŲŹĒµēøŗŠŌ×ī“óµÄŌŖĖŲ | |
| B£® | Y”¢ZµÄŅõĄė×Óµē×Ó²ć½į¹¹¶¼ÓėRŌ×ÓµÄĻąĶ¬ | |
| C£® | pÄܼ¶Ī“³É¶Ōµē×Ó×ī¶ąµÄŹĒZŌŖĖŲ | |
| D£® | WŌŖĖŲµÄµŚŅ»µēĄėÄÜŠ”ÓŚYŌŖĖŲµÄµŚŅ»µēĄėÄÜ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¼ĘĖćĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā

| A£® | øĆ¹ż³ĢÖŠÓŠ¼«ŠŌ¼üµÄ¶ĻĮŃŗĶŠĪ³É | B£® | øĆ¹ż³ĢÖŠµÄXŗĶY¾łĪŖ»ī»Æ·Ö×Ó | ||
| C£® | ¼ÓČė“߻ƼĮÄÜŌö“óXŗĶY·Ö×ÓµÄÄÜĮæ | D£® | øĆ¹ż³Ģ²»ÄÜĻū³ż“óĘųĪŪČ¾Īļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
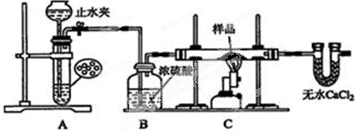
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
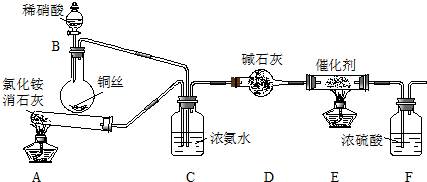

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÕāČżÖÖĪļÖŹ¶¼ŹōÓŚĘųĢ¬Ģž | |
| B£® | ŅŅČ²ÖŠĢ¼µÄÖŹĮæ·ÖŹż×īŠ” | |
| C£® | äåĖ®ÄÜÓėŅŅĻ©ŗĶŅŅČ²¼Ó³É£¬µ«²»ÄÜÓėŅŅĶé·“Ó¦ | |
| D£® | Ņ»øö·Ö×ÓÖŠ£¬¹²ÓƵē×Ó¶Ō×ī¶ąµÄĪļÖŹŹĒŅŅĶé |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CSOµÄµē×ÓŹ½£ŗ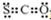 | B£® | NaClOµÄµē×ÓŹ½£ŗ | ||
| C£® | CO2µÄ·Ö×ÓŹ¾ŅāĶ¼£ŗ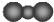 | D£® | “ĪĀČĖįµÄ½į¹¹Ź½£ŗH-Cl-O |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com