
【题目】常温下,将一定量的钠铝合金置于水中,合金全部溶解,并放出氢气,得到![]()
![]() 的溶液,然后用
的溶液,然后用![]() 的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是
的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法不正确的是
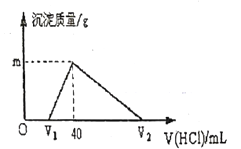
A. 原合金质量为![]()
B. 产生氢气的体积为![]() (标准状况下)
(标准状况下)
C. 图中![]() 的值为1.56
的值为1.56
D. 图中![]() 为100
为100
【答案】B
【解析】
由图象可知,向合金溶解后的溶液中加盐酸,先发生NaOH+HCl═NaCl+H2O,后发生NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,最后发生Al(OH)3+3HCl═AlCl3+3H2O,合金溶解后溶液的![]() ,说明氢氧化钠过量,剩余的氢氧化钠的物质的量为0.02L×1mol/L=0.02mol,由NaOH+HCl═NaCl+H2O可知:则V1为0.02mol÷1mol/L=0.02L=20mL,生成沉淀时消耗的盐酸为40mL-20mL=20mL,其物质的量为由0.02L×1mol/L=0.02mol,依据铝守恒可知,合金中含铝0.02mol,含钠0.04mol,由Al(OH)3+3HCl═AlCl3+3H2O,可知溶解Al(OH)3需要1mol/L的盐酸体积为60ml,则V2=40ml
,说明氢氧化钠过量,剩余的氢氧化钠的物质的量为0.02L×1mol/L=0.02mol,由NaOH+HCl═NaCl+H2O可知:则V1为0.02mol÷1mol/L=0.02L=20mL,生成沉淀时消耗的盐酸为40mL-20mL=20mL,其物质的量为由0.02L×1mol/L=0.02mol,依据铝守恒可知,合金中含铝0.02mol,含钠0.04mol,由Al(OH)3+3HCl═AlCl3+3H2O,可知溶解Al(OH)3需要1mol/L的盐酸体积为60ml,则V2=40ml![]() 60ml=100ml,此时溶液中的溶质为NaCl、AlCl3。
60ml=100ml,此时溶液中的溶质为NaCl、AlCl3。
A.根据上述分析可知,当加入1mol/L盐酸40ml时溶液中只有NaCl,所以n(NaCl)=0.4mol,依据钠守恒,原合金中含钠0.4mol,依据NaAlO2+HCl+H2O═NaCl+Al(OH)3↓沉淀铝消耗1mol/L盐酸20ml,说明n(NaAlO2)=0.2mol,则由钠元素及铝元素守恒可知,合金的质量为0.04mol×23g/mol+0.02mol×27g/mol=1.46g,故A正确;
B.依据A的分析,合金中含钠0.4mol、铝0.2mol。又2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,可知生成氢气的物质的量为0.02mol+0.03mol=0.05mol,其标况下的体积为0.05mol×22.4L/mol=1.12L,故B错误;
C.由上述计算可知,生成Al(OH)3沉淀为0.02mol,其质量为0.02mol×78g/mol=1.56g,故C正确;
D. 由Al(OH)3+3HCl═AlCl3+3H2O可知,溶解沉淀需要0.06molHCl,其体积为60mL,则V2为40mL+60mL=100mL,故D错误;故D错误。
本题答案为B。


科目:高中化学 来源: 题型:
【题目】有下列3种有机化合物A:CH2=CH2、B:![]() 、C:CH3COOH。
、C:CH3COOH。
(1)写出化合物A、C中官能团的名称:___________、_______。
(2)3种化合物中能使溴的四氯化碳溶液褪色的是______(写名称),该反应的化学方程式为____。该物质在农业上用作水果的________。
(3)B的名称是_______,它的分子具有______(填分子构型)结构,是否存在单双键交替结构?___(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒压条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
2NH3(g),若将2 mol氮气和3 mol氢气充入密闭容器中,反应达平衡时,氨气的体积分数为a。保持相同条件,在密闭容器中分别充入下列物质, 反应达平衡时,氨气的体积分数可能为a的是( )
A. 2 mol N2和6 mol H2 B. 1 mol N2和2 mol NH3
C. 1 mol N2、3 mol H2和2 mol NH3 D. 2 mol N2、3 mol H2和1 mol NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
② 苯环上原有的取代基对新导入的取代基进入苯环的位置有显著影响。
以下是用苯作原料制备一系列化合物的转化关系图:

(1)A转化为B的化学方程式是_________________________。
(2)图中“苯→①→②”省略了反应条件,请写出①、②物质的结构简式:
①________________,②____________________。
(3)苯的二氯代物有__________种同分异构体。
(4)有机物 的所有原子_______(填“是”或“不是”)在同一平面上。
的所有原子_______(填“是”或“不是”)在同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色透明的酸性溶液中,能大量共存的离子组是
A. NH4+ NO3- Al3+ Cl— B. K+ SO42- HCO3- Na+
C. Ca2+ NO3- CO32- Na+ D. Cu2+ K+ SO42- Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(![]() )可用作橡胶的低温硫化剂和粘结剂,在工业上具有重要的应用.某实验室研究小组通过查阅硫与氯气反应的相关资料,得知:
)可用作橡胶的低温硫化剂和粘结剂,在工业上具有重要的应用.某实验室研究小组通过查阅硫与氯气反应的相关资料,得知:![]() ,纯净的氯气在110~140℃时可以与硫反应得到淡红色的
,纯净的氯气在110~140℃时可以与硫反应得到淡红色的![]() 粗产品.
粗产品.
有关物质的部分性质如下表:
物质 | 外观(常温下) | 熔点/℃ | 沸点/℃ | 化学性质 |
| 淡黄色固体 | 112.8 | 444.6 | 略 |
| 淡黄色液体 |
| 135.6 | ①遇水剧烈反应,出现黄色浑浊,并生成两种刺激性气味的气体 ②能与 ③温度过高易分解,300℃以上完全分解 |
| 红色液体 |
| — | 59.6℃发生完全分解,分解产物为 |
在需要利用如下仪器和药品制取纯净的氯气,并且进一步与硫反应来制备![]() .
.
提供的仪器:
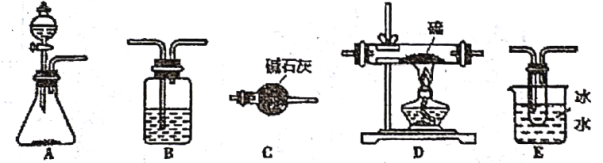
提供的药品:
浓盐酸、浓![]() 、
、![]() 、
、![]() 、饱和
、饱和![]() 溶液、碱石灰、硫磺、
溶液、碱石灰、硫磺、![]() 溶液、冰水、饱和食盐水.
溶液、冰水、饱和食盐水.
(1)现需要使用装置A来制备氯气,写出制备![]() 的离子方程式:______
的离子方程式:______
(2)利用所提供的仪器组合实验装置,写出相应的连接顺序(仪器B可使用2次)______;第二次装置B中的药品是______;
(3)![]() 分子中各原子均达到8电子稳定结构,写出其电子式_______;
分子中各原子均达到8电子稳定结构,写出其电子式_______;![]() 遇水剧烈反应,出现黄色浑浊,并生成两种刺激性气味的气体,写出相关化学方程式:______.
遇水剧烈反应,出现黄色浑浊,并生成两种刺激性气味的气体,写出相关化学方程式:______.
(4)装置C的作用是______.
(5)实验过程中需要控制装置D的加热温度,并且需要控制好![]() 的通入量,原因是?______.
的通入量,原因是?______.
(6)装置E中收集到的粗产品![]() 呈淡红色,如何进一步提纯?______.
呈淡红色,如何进一步提纯?______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g) ![]() 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-2a kJ·mol-l
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂可以加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某体系内有反应物和生成物5种物质:FeCl3、FeCl2、H2S、S、HCl,已知FeCl2为生成物,则另一生成物是
A. FeCl3 B. H2S C. S D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1L恒容密闭容器中加入lmol的N2(g)和3molH2(g)发生反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
2NH3(g) △H<0, NH3的物质的量与时间的关系如下表所示,下列说法不正确的是( )
时间(min) | 0 | t1 | t2 | t3 |
NH3物质的量(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min,v(NH3)=0.2/t1mol·L-1·min-1
B. t3时再加入1mol的N2(g)和3molH2(g),反应达新平衡时,c(N2)>0.85mol·L-1
C. N2(g)+3H2(g) ![]() 2NH3(g)的活化能小于2NH3(g)
2NH3(g)的活化能小于2NH3(g) ![]() N2(g)+3H2(g)的活化能
N2(g)+3H2(g)的活化能
D. 升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com