
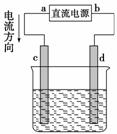
下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336 mL (标准状况)气体。回答:
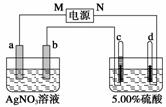
(1)直流电源中,M为__________极。
(2)Pt电极上生成的物质是________,其质量为__________________________g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶______∶______∶________。
(4)AgNO3溶液的浓度________(填“增大”、“减小”或“不变”,下同),AgNO3溶液的pH______,硫酸的浓度__________________________,硫酸的pH________。
(5)若硫酸的质量分数由5.00%变为5.02%,则原有5.00%的硫酸________g。
答案 (1)正 (2)Ag 2.16 (3)2  1 (4)不变 不变 增大 减小 (5)45.18
1 (4)不变 不变 增大 减小 (5)45.18
解析 电解5.00%的稀硫酸溶液,实际上是电解其中的水。因此在该电解池中发生反应:2H2O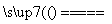 2H2↑+O2↑,V(H2)∶V(O2)=2∶1。据此可确定d极为阴极,则电源的N极为负极,M极为正极。在336 mL气体中,V(H2)=
2H2↑+O2↑,V(H2)∶V(O2)=2∶1。据此可确定d极为阴极,则电源的N极为负极,M极为正极。在336 mL气体中,V(H2)=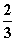 ×336 mL=224 mL,为0.01 mol;V(O2)=
×336 mL=224 mL,为0.01 mol;V(O2)=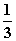 ×336 mL=112 mL,为0.005 mol。说明电路上有0.02 mol电子转移,因此在b极(Pt、阴极)产生Ag:0.02 mol×108 g·mol-1=2.16 g,即0.02 mol的Ag。则n(e-)∶n(Ag)∶n(O2)∶n(H2)=0.02∶0.02∶0.005∶0.01=2∶2∶
×336 mL=112 mL,为0.005 mol。说明电路上有0.02 mol电子转移,因此在b极(Pt、阴极)产生Ag:0.02 mol×108 g·mol-1=2.16 g,即0.02 mol的Ag。则n(e-)∶n(Ag)∶n(O2)∶n(H2)=0.02∶0.02∶0.005∶0.01=2∶2∶ ∶1。由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电解池,在通电一定时间后,在Pt电极上放电所消耗溶液中Ag+的物质的量等于Ag电极被还原给溶液补充的Ag+的物质的量,因此AgNO3溶液的浓度不变,溶液的pH也不变。电解5.00%的稀硫酸溶液时,由于其中的水发生电解,因此硫酸的浓度增大,H+的浓度增大,故溶液的pH减小。设原5.00%的硫酸的质量为x,电解时消耗水0.01 mol×18 g·mol-1=0.18 g,则5.00%x=5.02%(x-0.18 g),解得x=45.18 g。
∶1。由Ag(阳)电极、Pt(阴)电极和AgNO3溶液组成的电解池,在通电一定时间后,在Pt电极上放电所消耗溶液中Ag+的物质的量等于Ag电极被还原给溶液补充的Ag+的物质的量,因此AgNO3溶液的浓度不变,溶液的pH也不变。电解5.00%的稀硫酸溶液时,由于其中的水发生电解,因此硫酸的浓度增大,H+的浓度增大,故溶液的pH减小。设原5.00%的硫酸的质量为x,电解时消耗水0.01 mol×18 g·mol-1=0.18 g,则5.00%x=5.02%(x-0.18 g),解得x=45.18 g。


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
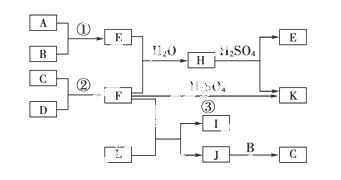
如图所示是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e )化合物J由两种元素组成,其相对分子质量为32。
)化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
(1)反应③的化学方程式___________。
(2)C的结构式____________;H的化学式__________。
(3)L的溶液与化合物E反应的离子方程式_____________。
(4)化合物J的化学式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家一直致力于研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h):
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的热化学方程式如下:
N2(g)+3H2O(l)===2NH3(g)+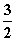 O2(g)
O2(g)
ΔH=765.2 kJ·mol-1
回答下列问题:
(1)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议:
________________________________________________________________________
________________________________________________________________________。
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为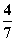 。计算:
。计算:
①该条件下N2的平衡转化率;
②该条件下反应2NH3(g)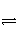
 N2(g)+3H2(g)的平衡常数。
N2(g)+3H2(g)的平衡常数。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是( )
A.AgNO3 B.Na2SO4 C.CuCl2 D.KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L-1的CuCl2溶液,B池中加入0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( )

A.2∶2∶4∶1 B.1∶1∶2∶1 C.2∶1∶1∶1 D.2∶1∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,若电解5 min时,测得铜电极的质量增加2.16 g。试回答:
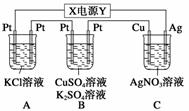
(1)电源中X极是__________(填“正”或“负”)极。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前[CuSO4]=____________。
(3)若A中KCl溶液的体积也是200 mL,电解后溶液中仍有Cl-,则电解后溶液的pH=
__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某水溶液M中存在的离子有Na+、A-、H+、OH-。根据题意回答下列问题:
(1)若溶液M由0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合而得,则溶液M的pH不可能________7(填“大于”、“小于”或“等于”)。
(2)若溶液M的pH>7,则[Na+]________[A-](填“>”、“<”或“=”)。
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,则下列说法中正确的是________(填字母)。
A.若溶液M呈中性,则溶液M中[H+]+[OH-]=2×10-7 mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
查看答案和解析>>
科目:高中化学 来源: 题型:
有关如图所示原电池的叙述 ,正确的是( )
,正确的是( )
(盐桥中装有含琼胶的KCl饱和溶液)
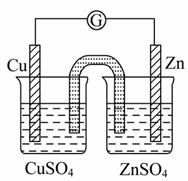
A.铜片上有气泡逸出
B.取出盐桥后,检流计依然发生偏转
C.反应中,盐桥中的K+会移 向CuSO4溶液
向CuSO4溶液
D.反应前后铜片质量不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com