
汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2—→2NO+2O,②2NO+O2—→2NO2,③O+O2—→O3。下列对该反应过程及生成物叙 述正确的是 ( )
述正确的是 ( )
A.NO2起催化剂作用 B.NO起催化剂作用
C.NO2只起氧化剂作用 D.O3与O2为同分异构体
科目:高中化学 来源: 题型:
下表中的数据是破坏1mol物质中的化学键所消耗的能量(kJ):
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
根据上述数据回答下列问题:
(1)下列物质本身具有的能量最低的是 。
A.H2 B.Cl2 C.Br2 D.I2
(2)相同条件下,X2 (X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
(3)某烃在标准状况下的密度为3.215g/L,,现取3.6g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重11g
则:①该烃的分子式为 ;
②该烃有多种同分异构体,其中与Cl2发生一氯取代的产物只有一种的烃的结构简式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ/mol)如图所示。请回答下列问题:
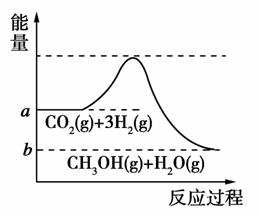
(1)观察图像可知上述反应过程中,断裂反应物中的化学键吸收的总能量________________(填“大于”、“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:_________。甲醇分子中的化学键类型是________________(填“离子键”或“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是________________,发生的是________________(填“氧化”或“还原”)反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:_____。
(5)下列事实能表明该反应已达平衡状态的是_______(填代号)。
A.CO2(g)的浓度不再发生变化
B.单位时间内消耗1 mol CO2的同时生成3 mol H2
C.在—个绝热的容器中,混合物的温度不再发生变化
D.在一个容积固定的容器内,压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
已知(HF)2(g)2HF(g) ΔH>0,且平衡体系的总质量(m总)与总物质的量(n总)之比在不同温度下随压强的变化曲线如图所示。下列说法正确的是( )
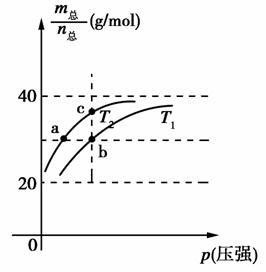
A.温度:T1<T2
B.平衡常数:K(a)=K(b)<K(c)
C.反应速率:vb>va
D.当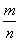 =30 g/mol时,n(HF):n[(HF)2]=2:1
=30 g/mol时,n(HF):n[(HF)2]=2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示的装置中发生反应2A2(g)+B2(g)2C(g) ΔH=-a kJ/mol(a>0),已知P是可自由滑动的活塞。在相同温度时关闭K,向A、B容器中分别充入2 mol A2和1 mol B2,两容器分别在500 ℃时达平衡,A中C的浓度为w1 mol/L,放出热量b kJ,B中C的浓度为w2 mol/L,放出热量c kJ。请回答下列问题:
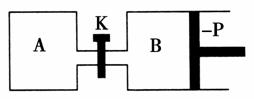
(1)此反应的平衡常数表达式为________________;若将温度升高到700 ℃,反应的平衡常数将________(填“增大”、“减小”或“不变”)。
(2)比较大小:w1________w2(填“>”、“=”或“<”),a、b、c由大到小的关系为________________。
(3)若打开K,一段时间后重新达平衡,容器B的体积将________
(填“增大”、“减小”或“不变”)。
(4)若让A、B体积相等且固定P,在B中改充入4 mol A2和2 mol B2,在500 ℃时达平衡后C的浓度为w3 mol/L,则w1、w3的关系为_________。
(5)能说明A中已达到平衡状态的是________________(填序号,有一个或多个选项符合题意)。
a.v(C)=2v(B2)
b.容器内气体压强保持不变
c.容器中气体的平均相对分子质量不随时间而变化
d.容器内的气体密度保持不变
(6)使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出C气体
b.适当升高温度
c.增大B2的浓度
d.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是 ( )
A.豆科植物通过根瘤菌吸收空气中的氮气,属于化学变化
B.汽车尾气中排放的氮氧化合物主要是由游离态氮转化来的
C.化石燃料燃烧通常不释放出氮氧化合物
D.植物秸秆燃烧时放出氮氧化合物,参与了氮的循环
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.已知2SO2(g)+ O2(g) 2SO3 (g) △H<0,该反应在任何温度下均可自发进行
2SO3 (g) △H<0,该反应在任何温度下均可自发进行
B.0.01 mol·L-1NaHCO3溶液中c(Na+)= c(HCO3 -)+ 2c(CO32-)+ c(H2CO3)
C.25℃,0.1mol·L-1 K2CO3溶液中c(H+)/ c(OH-) =l.0 × l0-a,该溶液的pH=7+0.5a
D.室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol·L-1 AgNO3溶液,先生成Ag2CrO4沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com