
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )
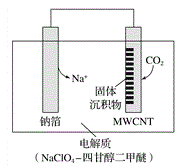
A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
【答案】C
【解析】金属钠失电子,做负极,电子由负极经导线流向正极,电流流向相反,由MWCNT→导线→钠箔,A正确;放电时,正极发生还原反应,CO2被还原为碳,电极反应式为3CO2+4Na++4e-===2Na2CO3+C,B正确;正极发生极反应为3CO2+4Na++4e-==2Na2CO3+C,根据反应关系可知,当转移0.2 mol e-时,生成碳酸钠的量的为0.1 mol,碳的量为0.05 mol,正极质量增重为0.1×106+0.05×12=11.2 g,负极发生反应:2Na-2e-=2Na+,根据反应关系可知,当转移0.2 mol e-时,消耗金属钠的量0.2mol,质量为0.2×23=4.6 g,所以两极的质量差为11.2g+4.6g=15.8 g,C错误;选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发,D正确;正确选项C。


科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:O2(g)+S(s)=SO2(g)△H=一akJ/mol
O2(g)+2SO2(g)![]() 2S03(g)△H=-bkJ/mol
2S03(g)△H=-bkJ/mol
写出SO3(g)分解生成O2(g)与S(s)的热化学方程式:_______________________。
(2)研究SO2催化氧化生成SO3的反应,回答下列相关问题:
①甲图是SO2(g)和SO3(g)的浓度随时间的变化情况。反应从开始到平衡时,用SO2表示的平均反应速率为_________。

②在一容积可变的密闭容器中充入20molSO2(g)和10molO2(g),02的平衡转化率随温度(T)、压强(P)的变化如图乙所示。则P1与P2的大小关系是P2_____P1(“>”“<”或“=”),A、B、C三点的平衡常数大小关系为______(用K、Kg、K。和“<”“>”或“=”表示)。
(3)常温下,H2SO3的电离平衡常数Ka1=1.5510-2Ka2=1.02×10-7。
①将SO2通入水中反应生成H2SO3。试计算常温下H2SO3![]() 2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
2H++S032-的平衡常数K=____。(结果保留小数点后两位数字)
②浓度均为0.1mol/L的Na2SO3、NaHSO3混合溶液中,![]() =______________。
=______________。
(4)往1L0.2mol/LNa2SO3溶液中加入等体积的0.1mol/L的CaCl2溶液,充分反应后(忽略溶液体积变化),溶液中c(Ca2+)=______。(已知,常温下Ksp(CaSO3)=1.28×10-9)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱金属按原子序数递增的顺序,其单质的性质变化不正确的是( )
A.单质的还原性依次增强
B.与水反应生成的氢氧化物碱性增强
C.与氧气反应的剧烈程度增强
D.熔点、沸点依次升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
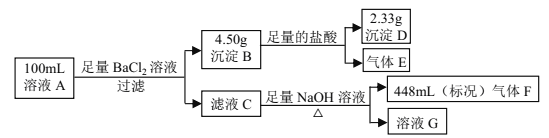
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2 + H2O![]() H+ + Cl-+HClO
H+ + Cl-+HClO
B. CaCO3加入醋酸中:CO![]() + 2H+ = CO2↑ + H2O
+ 2H+ = CO2↑ + H2O
C. 用惰性电极电解MgCl2溶液:2Cl-+2H2O ![]() H2↑+ Cl2↑ +2OH-
H2↑+ Cl2↑ +2OH-
D. 酸性KMnO4溶液滴入FeSO4溶液中:MnO![]() + Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
+ Fe2+ + 8H+ = Mn2+ + Fe3+ + 4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时 H2C2O4 的 pKa1=1.22,pKa2=4.19,CH3COOH 的 pK a=4.76,K 代表电离平衡常数,pK = -1gK。下列说法正确的是
A. 浓度均为 0.1mol·L-1NH4HC2O4 和 CH3COONH4 溶液中:c(NH4+)前者小于后者
B. 将 0.1mol·L-1 的 K2C2O4 溶液从 25℃升温至 35℃,c(K+)/c (C2O42-) 减小
C. 0.1 mol·L-1K2C2O4 溶液滴加盐酸至 pH=1.22:c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 向 0.1 mol·L-1CH3COONa 溶液中滴加少量 0.1 mol·L-1H2C2O4 溶液:CH3COO- + H2C2O4 = CH3COOH + HC2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使Fe(OH)2悬浊液完全转化为Fe(OH)3而又不引入新的杂质,最好选择的氧化剂是( )
A. 氯水B. HNO3C. Na2O2D. H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com