

分析 (1)图象化合价和物质分类可知Y为+6价硫元素的氧化物;
(2)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体,原子守恒可知无毒气体应为二氧化碳,结合原子守恒配平书写化学方程式;
(3)不溶性的硫化亚铁[FeS]固体和稀硫酸混合反应生成硫化氢气体和硫酸亚铁,硫化亚铁为难溶固体,硫化氢是气体不能拆分为离子;
(4)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2;
②依据化学方程式定量关系计算Na2S2O3的物质的量,V=$\frac{n}{c}$计算得到需要溶液体积;
解答 解:(1)根据图象化合价和物质分类可知,Y为+6价硫元素的氧化物,化学式为SO3,故答案为:SO3;
(2)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体,原子守恒可知无毒气体应为二氧化碳,反应的化学方程式为:2CO+SO2$\frac{\underline{\;催化剂\;}}{\;}$2CO2+S,故答案为:2CO+SO2$\frac{\underline{\;催化剂\;}}{\;}$2CO2+S;
(3)不溶性的硫化亚铁[FeS]固体和稀硫酸混合反应生成硫化氢气体和硫酸亚铁,硫化亚铁为难溶固体,硫化氢是气体不能拆分为离子,硫酸、硫酸亚铁是溶于水的强电解质,可以拆分成离子,反应的离子方程式为:FeS+2H+=Fe2++H2S↑,
故答案为:FeS+2H+=Fe2++H2S↑;
(4)①Na2S2O3中S为+2价,从氧化还原的角度分析,反应物中S元素化合价必须分别大于2和小于2,a中S化合价都小于2,c中S的化合价都大于2,bd符合题意,
故答案为:bd;
②化学方程式计算,设需要Na2S2O3+物质的量为x,反应的氯气物质的量=$\frac{2.24L}{22.4l/mol}$=0.1mol,
Na2S2O3+4Cl2+5H2O═2NaCl+2H2SO4+6HCl
1 4
x 0.1mol
x=0.025mol
理论上需要0.00100mol/L Na2S2O3溶液的体积V=$\frac{0.025mol}{0.00100mol/L}$=25L,
故答案为:25;
点评 本题考查了硫其化合物性质,化学方程式计算应用,注意离子方程式书写和元素化合价的判断,题目难度中等.


科目:高中化学 来源: 题型:解答题

| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | |
| 然后溶液从无色逐渐变黄绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L该溶液中含有NaOH 4.0 g | |
| B. | 给NaOH溶液通电,使NaOH发生电离 | |
| C. | NaOH的电离方程式是:NaOH═Na++OH- | |
| D. | NaOH溶液能导电,是因为溶液中有自由移动的Na+、OH-离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某蓝色溶液中加NaOH溶液,生成蓝色沉淀,说明原溶液中有Cu2+ | |
| B. | 某溶液中加BaCl2溶液,生成白色沉淀,继续滴加稀硝酸沉淀不溶解,说明原溶液中有SO42- | |
| C. | 某溶液中加硝酸银溶液,生成白色沉淀,继续滴加稀硝酸有部分沉淀不溶解,说明原溶液中一定有Cl- | |
| D. | 某溶液中加稀硫酸溶液生成无色无味气体,该气体能使澄清石灰水变浑浊,说明原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
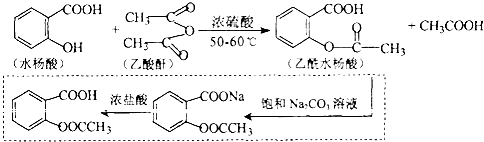


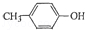 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 10HCl□
10HCl□查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com