
| A. | 46gNO2和N2O4的混气体中,含氮原子数目是NA | |
| B. | 1.0L 0.1mol/L的NaF溶液中,含F-离子数目是0.1NA | |
| C. | 11.2L的H2中,含有的电子数目是NA | |
| D. | 1molFeCl3跟沸水完全反应转化为氢氧化铁胶体,其中胶体粒子的数目是NA |
分析 A.NO2、N2O4中N与O个数比为1:2,NO2和N2O4的最简式均为NO2;
B.负离子为弱酸根离子,部分发生水解;
C.气体状况未知;
D.氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶体中胶粒的数目.
解答 解:A.NO2、N2O4中N与O个数比为1:2,NO2和N2O4的最简式均为NO2,46g NO2和N2O4混合气体中含有NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,含氮原子数为1mol,氮原子数目是NA,故A正确;
B.1.0L 0.1mol/L的NaF溶液中含有氟化钠0.1mol,因为氟化钠为强碱弱酸盐,所以部分氟离子水解,含F-离子数目小于0.1NA,故B错误;
C.气体状况未知,无法确定氢气的物质的量,故C错误;
D.1mol FeCl3和沸水完全反应转化为氢氧化铁胶体后,由于氢氧化铁胶粒为氢氧化铁的聚集体,所以胶体粒子的物质的量一定小于1mol,胶粒数一定小于NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的计算与判断,掌握阿伏伽德罗常数与摩尔质量、物质的量等物理量之间的转化关系,注意气体摩尔体积适用对象和条件,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| D. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | CO2和H2 | C. | NaCl和HCl | D. | CCl4和KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | |
| B. | 2CH3CH2+O2$→_{△}^{Cu}$2ch3CHO+2H20 | |
| C. | ClCH2=CH2+NaOH$→_{△}^{水}$HOCH2CH=CH2+NaCl | |
| D. | 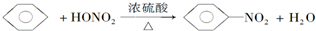 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数为35的同位素的原子质量百分比为75% | |
| B. | 该元素有二种同位素 | |
| C. | 该元素的双原子分子的平均相对分子质量为72 | |
| D. | 该元素的一种同位素的质量数为36 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 41.7 g | B. | 50 g | C. | 43 g | D. | 60 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
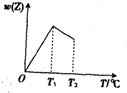 由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行如图所示的反应:X(g)+Y(g)?nZ(g),经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:
由等物质的量的X气体和Y气体组成的混合气体,在一定条件下进行如图所示的反应:X(g)+Y(g)?nZ(g),经时间t后,产物Z气体在反应混合物中的物质的量百分数与温度的关系如图所示,经分析可知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
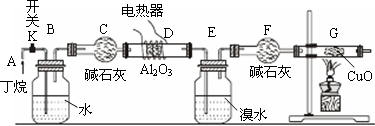
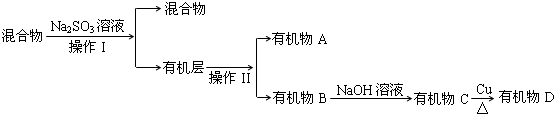
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com