
【题目】分离混合物在工业生产中应用广泛.某含有金属钨(W)、WO2、WO3、W2O5的混合物,欲从该混合物中分离出WO3和W2O5,并冶炼金属钨,其流程如图所示.

请阅读资料卡片并回答下列问题.
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液.
ii.WO3几乎不与无机酸反应.
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶性组分及残渣的过程.若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中).
溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
①100g/L NaOH ②300g/LNa2CO3 ③50g/L Na2CO3 ④饱和Na2C2O4 ⑤饱和Na2C2O4(在CO2气氛下浸取) | 25 7 30 60 120 | 72.3 76.4 100 4.2 <0.5 | 100 100 100 100 100 | 未 检 出 | 未 检 出 |
(1)步骤Ⅰ和Ⅳ均要进行的操作是____________________________________________。
(2)WO3既属于金属氧化物,也属于__________(填“酸性”、“碱性”)氧化物,与NaOH溶液反应的离子方程式是__________________________________________________。
(3)步骤Ⅰ是将WO3分离出来,选用的试剂a是⑤,理由是___________________________。
(4)步骤Ⅳ可将W2O5分离出来,选用的试剂b是_______________,固体E中含有的物质是_______________,D中的溶质是_______________。
【答案】 过滤 酸性 WO3+2OH-=WO42-+H2O WO3的浸取率为100%,W2O5的浸取率很低 50g/LNa2CO3 W、WO2 Na2WO4
【解析】(1)经过步骤Ⅰ和Ⅳ后分别得到溶液和不溶固体,故均要进行的操作是过滤。
(2)WO3易溶于NaOH溶液并形成Na2WO4,故WO3属于酸性氧化物,与NaOH溶液反应的离子方程式是WO3+2OH-=WO42-+H2O。
(3)根据WO3在饱和Na2C2O4(在CO2气氛下浸取)溶液中的浸取率为100%,而其他含W的物质基本上不被浸出,故步骤Ⅰ中要将WO3分离出来,选择的试剂a是饱和Na2C2O4(在CO2气氛下浸取),答案为:WO3的浸取率为100%,W2O5的浸取率很低。
(4)含钨混合物经过饱和Na2C2O4(在CO2气氛下浸取)浸取后,得到固体A的成分为W、WO2和W2O5,步骤Ⅳ要将W2O5分离出来,根据三种物质在不同溶剂中的浸取率可知,当选用的溶剂为50g/LNa2CO3时,W2O5的浸取率为100%,而W、WO2不溶解,故b试剂为50g/LNa2CO3;固体E中含有的物质为W、WO2;W2O5可溶于Na2CO3溶液,并被氧化为Na2WO4,故D中的溶质是Na2WO4。


科目:高中化学 来源: 题型:
【题目】实验是化学研究的基础。下列关于各实验装置的叙述正确的是
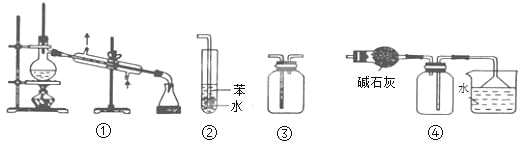
A. 装置③可用于收集H2、CO2、Cl2、NH3等气体
B. 装置②可用于吸收NH3或HCl气体,并防止倒吸
C. 装置①常用于分离互不相溶的液体混合物
D. 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】你认为下列说法不正确的是( )
A.氢键存在于分子之间,不存在于分子之内
B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大
C.NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子
D.冰熔化时只破坏分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图与表述一致的是( )

A. 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A
B. 用图②所示装置蒸发FeCl3溶液制备无水FeCl3
C. 图③可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D. 图④电解饱和食盐水的装置中,溶液B为浓氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a mol C2H4跟b mol H2在密闭容器中,在适当条件下,反应达到平衡时生成了p mol C2H6 , 若将所得平衡混合气体混合气体,生成CO2和H2O,所需氧气的物质的量应是( )
A.(3a+0.5b)mol
B.(3a+0.5b)mol
C.(3a+0.5b+3p)mol
D.(3a+0.5b﹣3p)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧(O3)生成.下列说法正确的是( )
A.O2和O3互为同位素
B.O2转化为O3为化学变化
C.相同物质的量的O2和O3的体积相同
D.相同质量的O2和O3含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
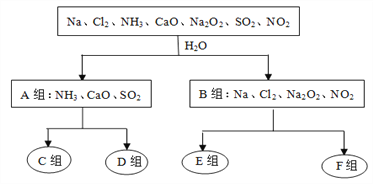
水溶液呈酸性 水溶液呈碱性 水作氧化剂 水既不作氧化剂也不作还原剂
(1)根据物质与水反应的情况,分成A、B组的分类依据是______________________________;
(2)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类别为____(填序号);
①金属氧化物 ②酸性氧化物 ③碱性氧化物 ④两性氧化物
(3)D组中的气体水溶液呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因:________________________________________________________________________________;
(4)F组中与水反应氧化剂与还原剂的之比是1:1的物质是______________(填化学式);
(5)SO2是形成酸雨的主要污染物,目前有一种较为有效的方法是在高空喷洒一种粉末状物质X,脱硫效果可达85%,其反应的化学方程式为:2X+2SO2+O2===2CaSO4+2CO2,由此可知X的化学式是_________;
(6)Cl2、Na2O2、SO2都能使品红褪色,其中漂白原理与其它两种物质不同的是_______________;将等物质的量的SO2、Cl2同时通入品红溶液中,实验现象是_________________________,产生该现象的原因是____________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com