
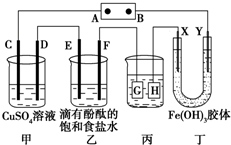
 如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:
如图所示装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中的溶液都是1mol?L-1 500mL(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.请回答:| 5.4 |
| 108 |
| 0.05 |
| 0.5 |
| 5.4 |
| 108 |
| 0.05 |
| 0.5 |
| ||
| ||


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
| A、常温下可用铝制容器贮存稀硝酸 |
| B、钠的化学性质活泼,可从CuSO4溶液中置换出Cu |
| C、干燥的氯气具有漂白性 |
| D、金属钠与氧气反应,条件不同产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O(l) 2H2(g)+O2(g)=2H2O(g) | ||||
B、H2(g)+Cl2(g)=2HCl(g)
| ||||
C、NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) NaOH(aq)+
| ||||
D、C(s)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13C和14C属于同一种元素,它们互为同位素 |
| B、1H和2H是不同的粒子,但它们的质子数相等 |
| C、14C 和14N的质量数相等,它们互为同位素 |
| D、6Li和7Li的电子数相等,但中子数不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 21.98 | 20.00 |
| 2 | 0.10 | 22.00 | 20.00 |
| 3 | 0.10 | 22.02 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com