
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 .
.分析 (1)地壳中含量最多的元素为O;
(2)表中金属性最强的元素为Na,金属性越强,最高价氧化物对应的水化物碱性越强;
(3)Al的质子数为13,原子结构中有3个电子层,最外层电子数为3;
(4)同周期从左向右非金属性增强;
(5)二氧化硅对光具有良好的全反射作用,Si为良好的半导体材料;
(6)N2和H2反应生成氨气.
解答 解:(1)地壳中含量最多的元素是氧(或氧元素),故答案为:氧(或氧元素);
(2)最高价氧化物对应的水化物碱性最强的是NaOH,故答案为:NaOH;
(3)Al的原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)同周期从左向右非金属性增强,则S和Cl相比,元素非金属性较强的是Cl,故答案为:Cl;
(5)可用来制造光导纤维的物质是二氧化硅(或SiO2),晶体硅的主要用途是制造半导体材料(制造集成电路、太阳能电池等),
故答案为:二氧化硅(或SiO2);制造半导体材料;
(6)工业上以N2和H2为原料,在高温、高压和催化剂存在的条件下制备NH3,反应的化学方程式为N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,故答案为:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
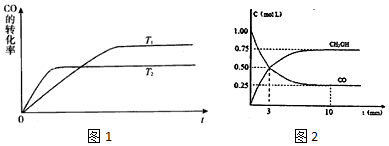
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
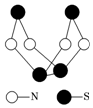 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.其中如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )| A. | 该物质的分子式为SN | |
| B. | 该物质的分子中只含共价键 | |
| C. | 该物质具有很高的熔、沸点 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 5 | 5 | 55 | 5 |
| 反应后质量/g | 27 | 待测 | 0 | 19 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
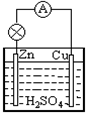 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
下列各指定粒子数目不等于阿伏加德罗常数的是
A.1g H2所含的原子个数
B.4g氦气所含的原子个数
C.23g金属Na全部转变为金属离子时失去的电子个数
D.16g O2所 含的分子个数
含的分子个数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com