
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:

(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
【答案】 H+ +OH-=H2O Al(OH)3 +OH-=AlO2-+2H2O 4 0.1 200 透过蓝色钴玻璃观察,火焰呈紫色 CO2 +AlO2- +2H2O=Al(OH)3↓+HCO3-
【解析】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体,氢气的物质的量为![]() 0.3mol,根据2Al~~3H2,混合中Al粉的物质的量为0.3mol×
0.3mol,根据2Al~~3H2,混合中Al粉的物质的量为0.3mol×![]() =0.2mol;向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,根据沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系图,可知:(1)OA段酸过量,发生酸碱中和反应,离子反应方程式为H+ +OH-=H2O;继续滴加KOH溶液将溶液里的Al3+和Mg2+转化为Al(OH)3和Mg(OH)2沉淀,BC段滴加KOH溶液,溶解生成的Al(OH)3沉淀,发生反应的离子方程式为Al(OH)3 +OH-=AlO2-+2H2O;
=0.2mol;向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,根据沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系图,可知:(1)OA段酸过量,发生酸碱中和反应,离子反应方程式为H+ +OH-=H2O;继续滴加KOH溶液将溶液里的Al3+和Mg2+转化为Al(OH)3和Mg(OH)2沉淀,BC段滴加KOH溶液,溶解生成的Al(OH)3沉淀,发生反应的离子方程式为Al(OH)3 +OH-=AlO2-+2H2O;
(2)B点为完全沉淀点,此时溶液中溶质K2SO4,根据原子守恒可知n(K+)=2n(SO42-)=2×0.3L×4mol/L=2.4mol,此时消耗KOH溶液体积为0.6L,则c(KOH)=![]() =4mol/L;BC段共消耗KOH溶液体积为0.1L,根据Al(OH)3 +OH-=AlO2-+2H2O可知Al(OH)3 的物质的量为4mol/L×0.1L=0.4mol;设氧化铝的物质的量为n mol,根据原子守恒2n mol+0.2 mol=0.4mol,n=0.1;
=4mol/L;BC段共消耗KOH溶液体积为0.1L,根据Al(OH)3 +OH-=AlO2-+2H2O可知Al(OH)3 的物质的量为4mol/L×0.1L=0.4mol;设氧化铝的物质的量为n mol,根据原子守恒2n mol+0.2 mol=0.4mol,n=0.1;
(3)C点对应的沉淀Mg(OH)2物质的量为 0.2mol,则生成沉淀Mg(OH)2和Al(OH)3 消耗KOH的物质的量为0.2mol×2+0.4mol×3=1.6mol,消耗KOH溶液的体积为![]() =400mL,则A点对应的数值为600mL-400mL=200mL;
=400mL,则A点对应的数值为600mL-400mL=200mL;
(4)K+的检验可用焰色反应,具体操作是透过蓝色钴玻璃观察,火焰呈紫色;
(5)C点对应的溶液中含有AlO2-,通入足量的CO2所发生反应的离子方程式为CO2 +AlO2- +2H2O=Al(OH)3↓+HCO3-;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】加热7.78g碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g。
(1)原混合物中碳酸氢钠的质量为______,反应的化学方程式为 ______________。
(2)将剩余固体溶于水,配成500mL溶液,所得溶液的物质的量浓度为______。取出该溶液50mL,向其中逐滴滴入0.2mol/L盐酸35mL,完全反应后在标准状况下生成二氧化碳的体积为_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
(1)氨气的制备

①氨气的发生装置可以选择上图中的________,反应的化学方程式为______________。
②预收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=1的溶液:Ag+、Al3+、Cl-、SO42-
B. 能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2-
C. ![]() =10-12的溶液:NH4+、Cu2+、NO3-、Cl-
=10-12的溶液:NH4+、Cu2+、NO3-、Cl-
D. 水电离产生的c(OH-)=10-12mol/L的溶液:K+、Fe2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列化学物质进行分类,正确的是
A.海水、冰水混合物、氨水均为混合物
B.SO3、CO2、CaO均为酸性氧化物
C.烧碱、纯碱、硫酸钡均为电解质
D.氢硫酸、盐酸、硝酸均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色稀溶液X中,可能含有如表所列离子中的某几种。
阴离子 | CO |
阳离子 | Al3+、Fe3+、Mg2+、NH |
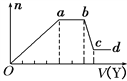
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示。
(1)若Y是盐酸,则溶液中含有的阳离子是______ ,ab段发生反应的总离子方程式为____________, Oa段上表中参加反应的离子的物质的量之比为________________________。
[要标明离子符号,如n(Fe3+)].
(2)若Y是NaOH溶液,则X中一定含有上表中的离子是________________________,它们的离子个数比为______________________________,[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列].ab段反应的离子方程式为______________________________, bc段反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。

已知:CeO2不溶于稀硫酸,也不溶于NaOH溶液。
回答下列问题:
(1)稀酸A的分子式是_____________________________________________。
(2)滤液1中加入H2O2溶液的目的是___________________________________________。
(3)设计实验证明滤液1中含有Fe2+___________________________________________。
(4)在酸性溶液中,已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe3O4,书写该反应的离子方程式____________________________________________________________。
(5)由滤液2生成Ce(OH)4的离子方程式_____________________________________。
(6)硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,但其在去除酸性废水中的悬浮物时效率降低,其原因是__________________________________________。
(7)取上述流程中得到的Ce(OH)4产品0.531 g,加硫酸溶解后,用浓度为0.l000 mol·L-1的FeSO 4标准溶液滴定至终点时(铈被还原为Ce3+ ),消耗25.00 mL标准溶液。该产品中Ce(OH)4的质量分数为______________ (结果保留两位有效数字),Mr(Ce)=140。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质能通过化合反应直接制得的是( )
①FeCl2②H2SO4 ③NH4NO3 ④HCl ⑤Fe(OH)3
A.只有①②③B.只有②③C.只有①③④D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 124g P4含有的P-P键的个数为6NA
B. 12g石墨中含有的C-C键的个数为2NA
C. 12g金刚石中含有的C-C键的个数为1.5NA
D. 60gSiO2中含Si-O键的个数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com