
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液是否含有SO42-时,在无其他阳离子干扰的条件下,先用盐酸酸化,所得溶液再加BaCl2溶液 | |
| B. | 为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化 | |
| C. | 检验溶液中是否含有Fe3+时,用硝酸酸化 | |
| D. | 定性检验SO32-,将BaCl2溶液用HNO3酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
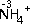
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3O3$\frac{\underline{\;放电\;}}{\;}$2O3 | B. | 2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | ||
| C. | Cl2+2NaOH═NaCl+NaClO+H2O | D. | CO+CuO $\frac{\underline{\;\;△\;\;}}{\;}$ Cu+CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g)△H1 | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g)△H2 | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O (g)?CO2(g)+H2(g)△H3 | K3 | ? | ? |
| A. | △H1<0,△H2>0 | |
| B. | 反应①②③的反应热满足关系:△H2-△H1=△H3 | |
| C. | 反应①②③的平衡常数满足关系:K1•K2=K3 | |
| D. | 要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(l);△H1 2H2(g)+O2(g)═2H2O(g);△H2 | |
| B. | S(g)+O2(g)═2SO2(g);△H1 S(s)+O2(g)═2SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$ O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$ Cl2(g)═HCl(g);△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com