
����Ŀ�������ң���Ҫ�ɷ�ΪAl��Al2O3 �� ��������CuO��SiO2��FeO��Fe2O3���ʣ�Ϊԭ�ϣ����Ƶ�Һ��ۺ��Ȼ���[Alm��OH��nCl3m��n]�������IJ��ֹ�����ͼ��ʾ�����ֲ���Ͳ�������ȥ���� 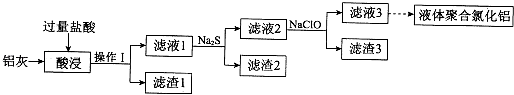
��֪ijЩ������������±���
���� | ���� |
Fe2S3 Al2S3 | ��ˮ��Һ�в����� |
FeS | ��ɫ��������ˮ������������ |
CuS | ��ɫ��������ˮ������������ |
��1������I�� �� Al2O3�����ᷴӦ�����ӷ���ʽ�� ��
��2������2Ϊ��ɫ���ú�ɫ���ʵĻ�ѧʽ�� ��
��3������Һ2�м���NaClO��Һ�����ٲ������ɫ��������ʱ��Һ��pHԼΪ3.7��NaClO�������� ��
��4������Һ3��pH����4.2��4.5������ˮ�ⷴӦ�õ�Һ��ۺ��Ȼ�������Ӧ�Ļ�ѧ����ʽ�� ��
��5������Һ3���Ҳ���Եõ�Һ��ۺ��Ȼ�����װ����ͼ��ʾ�������ӽ���Ĥֻ����������ͨ�����缫Ϊ���Ե缫���� 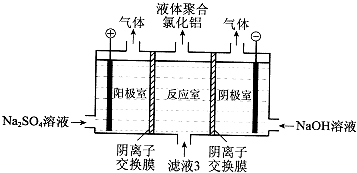
��д�������ҵĵ缫��Ӧ�� ��
�ڼ����ڷ�Ӧ�������ɾۺ���������ԭ���� ��
���𰸡�
��1�����ˣ�Al2O3+6H+=2Al3++3H2O
��2��CuS
��3����Fe2+����ΪFe3+ �� ʹFe3+ת��ΪFe��OH��3����
��4��mAlCl3+nH2O?Alm��OH��nCl3m��n+nHCl
��5��2H2O+2e��=H2��+2OH�����������з�Ӧ���е�������ͨ�������ӽ���Ĥ���������ң��������е�����������ͨ�������ӽ���Ĥ���뷴Ӧ�ң����ɾۺ��Ȼ���
���������⣺���ң���Ҫ�ɷ�ΪAl��Al2O3 �� ��������CuO��SiO2��FeO��Fe2O3���ʣ��ӹ������ᣬ��������1ΪSiO2 �� ��Һ1�к���Al3+��Fe3+��Fe2+��Cu2+�ȣ���Һ�м����ƣ�Cu2+ת��ΪCuS���������ˣ���Һ2�м�NaClO��������������Ϊ�����ӣ���������ˮ�����������������������ˣ���Һ3��Ϊ�Ȼ�������1������I�Ƿ�������Һ������IJ����ǹ��ˣ�Al2O3�����ᷴӦ�����Ȼ�����ˮ���䷴Ӧ�����ӷ���ʽΪ��Al2O3+6H+=2Al3++3H2O�����Դ��ǣ����ˣ�Al2O3+6H+=2Al3++3H2O����2����Һ�к���ͭ���ӣ��������ƣ�����CuS��ɫ���������Դ��ǣ�CuS����3������Һ2�к����������ӣ�����NaClO��Һ���������ӱ�NaClO����Ϊ�����ӣ���������ˮ�����������������������Դ��ǣ���Fe2+����ΪFe3+ �� ʹFe3+ת��ΪFe��OH��3��������4��AlCl3ˮ������Alm��OH��nCl3m��n��HCl������ԭ���غ���ƽ����ʽΪ��mAlCl3+nH2OAlm��OH��nCl3m��n+nHCl�� ���Դ��ǣ�mAlCl3+nH2OAlm��OH��nCl3m��n+nHCl����5����������ˮ�ĵ���������ӵõ��������������������ĵ缫��ӦʽΪ��2H2O+2e��=H2��+2OH�������Դ��ǣ�2H2O+2e��=H2��+2OH�����������ӽ���Ĥֻ����������ͨ�����������з�Ӧ���е�������ͨ�������ӽ���Ĥ���������ң��������е����������ӽ��뷴Ӧ������Alm��OH��nCl3m��n�����Դ��ǣ��������з�Ӧ���е�������ͨ�������ӽ���Ĥ���������ң��������е�����������ͨ�������ӽ���Ĥ���뷴Ӧ�ң����ɾۺ��Ȼ�����


 ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������壬�������ÿ������5����ԭ�ӽ��ܶ���(��ͼ���������ʡ��)����ԭ�Ӱ뾶ΪAcm��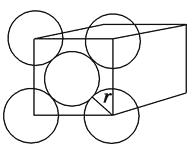
��
��1����������С��һ�������庬������ԭ�ӡ�
��2������ܶ�Ϊg��cm��3��(�ô�A����ʽ��ʾ)
��3����ԭ�ӿռ�ռ����Ϊ��(Au�����ԭ������Ϊ197���ô�A����ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���Cu��H2SO4��Ӧ�IJ�����������ʽ���̽���� ��������̽��
��ͭ��Ũ���ᷴӦ�Ĺ����У������к�ɫ���ʳ��֣�������������������ϣ�
����1��X���߾������������ͭ��Ũ���ᷴӦ���ɵĺ�ɫ����Ϊ�е�һ�ֻ����֣�
����2��
����/molL��1 | ��ɫ���ʳ��ֵ��¶�/��C | ��ɫ������ʧ���¶�/��C |
15 | Լ150 | Լ236 |
16 | Լ140 | Լ250 |
18 | Լ120 | ����ʧ |
��1������������2�ɵó�����ȷ��������ѡ��������ĸ��ţ� a��ͭ��Ũ���ᷴӦʱ���漰�ķ�Ӧ���ܲ�ֹһ��
b������Ũ��ѡ���ʵ����ɱ����������г��ֺ�ɫ����
c���÷�Ӧ����������֮һ������Ũ�ȣ�15molL��1
d������Ũ��Խ��ɫ���ʳ���Խ�죬Խ����ʧ
��2��Cu������16molL��1Ũ���ᷴӦʱ����80��C�Ժ������¶ȵ������ߣ���Ӧ������ͭ�����������ӣ���CuSȴ���٣�����250��C����ʱ��CuS�ڷ�Ӧ����ȫ��ʧ�ij�����Һ��CuS��ʧ�Ļ�ѧ����ʽΪ ��
��3����������̽�� Cu��ŨH2SO4��Ӧ���ɵ�CuSO4����ijЩ�ض����ʣ�һ��Ũ��CuSO4��Һ��NaHCO3��Һ��Ӧ����������ɫ����״����������������CuCO3 �� Cu��OH��2 �� ����CuCO3��Cu��OH��2�Ļ���
1����������Cu��OH��2 �� ���ɳ��������ӷ���ʽ�� ��
2��Ϊ�˽�һ��̽�������ijɷ֣���Ƶ�ʵ��װ����ͼ��
ʵ���������Ϊ
a��ȡ������Ʒ100����B�У����װ�õ�������
b����K1 �� K3 �� �ر�K2 �� K4 �� ͨ����������
c���ر�K1 �� K3 �� ��K2 �� K4 �� ��ַ�Ӧ
d����Ӧ�����ر�K2 �� ��K1 �� ��ͨ����������
e�����װ��D������������22g
�ٲ���b��������
����������ƷΪCuCO3��Cu��OH��2�Ļ�����Cu��OH��2����������Ϊ �� �������в���d�����ʹ���Cu��OH��2����������Ϊ���ƫ�ߡ�����Ӱ�족��ƫ�͡���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��W���ֶ���������Ԫ�������ڱ��е����λ����ͼ��ʾ������˵������ȷ���ǣ� �� 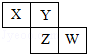
A.W��ԭ��������������X��ԭ��������3��
B.ZԪ�ؿ����ǽ���Ԫ��
C.W����̬�⻯����ȶ���һ����Y��ǿ
D.����Ԫ�ص�ԭ���п��ܾ�������ԭ���γ�18���ӷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڶ����ڵ�һ��Ԫ����
A. Al��Si��S B. Li��Mg��Fr C. H��O��K D. Na��S��Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�Ӧ2KMnO4+16HCl�T2KCl+2MnCl2+5Cl2��+8H2O�У��������� �� ���������� �� ���������뻹ԭ�������ʵ���֮���� �� ��������δ��������HCl������֮��Ϊ �� ����7.3g HCl�������������Cl2������Ϊg��ת�Ƶĵ�����Ϊmol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л����У��ܸ���ˮ�����ӳɷ�Ӧ�����ܱ����Ը��������Һ��������()
A. ��ϩB. �� C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������������ߣ��ϵ�ر�����м��д����������ֱ��ᵽ�����ճ��ϣ�����Ҫԭ���ǣ� ��
A. ���õ����ǵĽ�������
B. ��������ʯī�缫
C. ��ֹ����й����Ӻ�Ǧ���ؽ������Ӷ�ˮ����������Ⱦ
D. ��ʹ�����й©�ĵ��Һ��ʴ������Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ���ܻ�óɹ�����( )
A. ����������Ȼ�̼�����ۻ���Ƴ��屽
B. ͨ�����Ը��������Һ�ɳ�ȥ�����е�������ϩ
C. ����ˮ�ɼ��𱽡�CCl4����ϩ
D. ���뱥�͵�̼������Һ��ȥ�Ҵ��е�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com