
科目:高中化学 来源: 题型:
向盛有紫色石蕊试液的试管中通入适量的CO2,紫色石蕊试液的试液变为
色,其反应的化学方程式为: 。
将反应后的溶液加热,则石蕊由 色变为 色,其反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一次夏令营活动中,同学们发现了一个深洞,打算进去看看,但洞内很黑,有人提议用手电筒照明,有人说用火把照明。根据所学的化学知识从安全角度考虑,你赞同哪种提议?请阐述理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图分别是铝元素,氯元素的原子结构示意图,下列叙述正确的是( )
A.铝原子第一电子层有3个电子
B.氯原子核内有17个质子
C.氯原子在化学反应中容易失去电子
D.氯与铝形成化合物的化学式为AlCl2
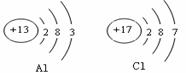
查看答案和解析>>
科目:高中化学 来源: 题型:
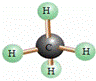
某物质的分子模型如图2所示,下列说法错误的是( )
A.该物质属于有机物
B.该物质的化学式为CH4
C.该物质的1个分子中含5个原子
D.该物质中碳、氢元素质量比为1︰4
查看答案和解析>>
科目:高中化学 来源: 题型:
玫瑰花中含有香茅醇、橙花醇和丁香油酚等物质;请计算:
(1)丁香油酚(C10H12O2)的相对分子质量为 ;(2)丁香油酚中碳、氢、氧三种元素的质量比 ;
(3)丁香油酚中碳元素的质量分数 (结果精确到0.1%);
(4)16.4g丁香油酚中含 g氧元素(结果精确到0.1g).
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是在相同温度下三种酸的一些数据,下列判断正确的是( )
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c(Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应制备甲醇。
Ⅰ:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)===CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_______________。
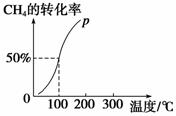 (2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室中,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室中,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平衡反应速率为____________________。
②100 ℃时反应Ⅰ的平衡常数为__________________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡c(H2)/c(CH3OH)减小
E.平衡常数K增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com