
【题目】下列关于工业生产说法正确的是![]()
A.氯碱工业中的阳离子交换膜阻止阳离子通过
B.在硫酸工业、合成氨工业、硝酸工业中,均必须对尾气进行吸收处理
C.工业上均用电解熔融氧化物的方法制金属镁和铝
D.在侯氏制碱工业中,向饱和氯化钠溶液中先通氨气,后通二氧化碳
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )

A.该反应的化学方程式为A(g)+3B(g)2C(g)
B.(t1+10)s时,升高温度,正、逆反应速率加快
C.在t1s时,V正(A)=0
D.若该反应在绝热容器中进行,也在t1时刻达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组在常温下测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案I:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案II:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是
A.溶液A和B均可以是盐酸或NaOH溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用浓硝酸,则测得铜的质量分数偏小
D.实验室方案Ⅱ更便于实施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物结构和性质的说法错误的是( )
A.分子式为C4H10O且能与 Na反应放出气体的结构共有4种
B.石油是混合物,可通过分馏得到汽油、煤油等纯净物
C.苯甲酸(![]() )分子中所有原子可能位于同一平面
)分子中所有原子可能位于同一平面
D.1mol盐酸美西律(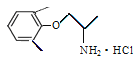 )最多可与3 mol H2发生加成
)最多可与3 mol H2发生加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 时,FeS的
时,FeS的![]() ,CuS的
,CuS的![]() ,ZnS的
,ZnS的![]() 常温时下列有关说法中正确的是( )
常温时下列有关说法中正确的是( )
A.FeS的溶解度大于CuS的溶解度
B.饱和CuS溶液中![]() 的浓度为
的浓度为![]()
![]()
C.向物质的量浓度相同的![]() 、
、![]() 的混合液中加入少量
的混合液中加入少量![]() ,只有FeS沉淀生成
,只有FeS沉淀生成
D.向饱和ZnS溶液中加入少量![]() 固体,ZnS的
固体,ZnS的![]() 变大
变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是两个实验装置(铁架台等辅助仪器略去未画)。
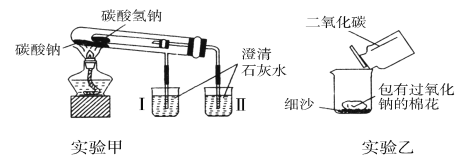
回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是________(填“Ⅰ”或“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是_________, 通过实验甲可比较出________(填“Na2CO3”或“NaHCO3”)更稳定。
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象:包有Na2O2的棉花着火燃烧。棉花能着火燃烧,说明该反应特点是________。
(3)取10.0 g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0 g。则原混合物中碳酸钠的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl2·6H2O、NH4Cl、H2O2、液氨、氯化铵为原料,在活性炭催化下合成了橙黄色晶体X。为测定其组成,进行如下实验。
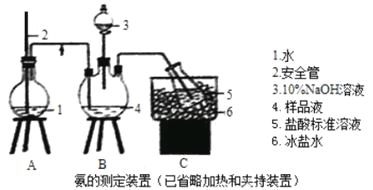
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1mLc1mol·L—1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用_____式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为____________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将___(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________;滴定终点时,若溶液中c(Ag+)=2.0×10—5mol·L—1,c(CrO42—)为______mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨、氯的物质的量之比为1:6:3,钴的化合价为______,制备X的化学方程式为____________________;X的制备过程中温度不能过高的原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是
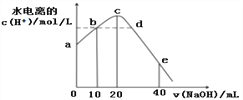
A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com