
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g)![]() CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。

③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
【答案】 -127.5 kJ/mol 催化剂(或提高催化剂的选择性) 0.12 mol/(L·min) 不能确定 2/9(或22.22%) ![]() atm-2 该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小 CH3OH+ NaOH
atm-2 该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小 CH3OH+ NaOH ![]() HCOONa+ 2H2 ↑ 2CO32--4e-==2CO2↑+O2↑
HCOONa+ 2H2 ↑ 2CO32--4e-==2CO2↑+O2↑
【解析】(1)已知常温下CH3OH、H2和CO的燃烧热分别为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则有①CH3OH(l)+O2(g)= CO2(g)+2H2O(l) △H1=-726.5kJ/mol,②H2(g)+ ![]() O2(g)= H2O(l) △H2=-285.5kJ/mol,③CO(g)+
O2(g)= H2O(l) △H2=-285.5kJ/mol,③CO(g)+ ![]() O2(g)= CO2(g) △H3=-283.0kJ/mol, 根据盖斯定律,由③+②×2-①得反应CO(g)+2H2(g)
O2(g)= CO2(g) △H3=-283.0kJ/mol, 根据盖斯定律,由③+②×2-①得反应CO(g)+2H2(g)![]() CH3OH(l)△H=-283.0kJ/mol+(-285.5kJ/mol)×2-(-726.5kJ/mol)= -127.5kJ/mol,即x= -127.5kJ/mol;为提高合成甲醇反应的选择性,关键因素是催化剂或提高催化剂的选择性;(2)①该化学反应0~10min的平均速率v(H2)=
CH3OH(l)△H=-283.0kJ/mol+(-285.5kJ/mol)×2-(-726.5kJ/mol)= -127.5kJ/mol,即x= -127.5kJ/mol;为提高合成甲醇反应的选择性,关键因素是催化剂或提高催化剂的选择性;(2)①该化学反应0~10min的平均速率v(H2)=  =0.12mol/(L·min);N点改变的条件未知,无法确定浓度变化是增大还是减小,M和N点的逆反应速率大小不能确定;②10min时容器内CH3OH、H2和CO的物质的量浓度分别为0.6mol/L、0.4mol/L、0.8mol/L,故CO的体积分数为
=0.12mol/(L·min);N点改变的条件未知,无法确定浓度变化是增大还是减小,M和N点的逆反应速率大小不能确定;②10min时容器内CH3OH、H2和CO的物质的量浓度分别为0.6mol/L、0.4mol/L、0.8mol/L,故CO的体积分数为![]() ;③温度不变,平衡常数不变,故TK下10min时,反应达平衡时CH3OH、H2和CO的物质的量浓度分别为0.6mol/L、0.4mol/L、0.8mol/L,体积分数分别为
;③温度不变,平衡常数不变,故TK下10min时,反应达平衡时CH3OH、H2和CO的物质的量浓度分别为0.6mol/L、0.4mol/L、0.8mol/L,体积分数分别为![]() 、
、![]() 、
、![]() ,KP=
,KP= =
= atm-2;实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图二,请分析1nK随T呈现上述变化趋势的原因是该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小;(3) ①利用NaOH干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为CH3OH+NaOH
atm-2;实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图二,请分析1nK随T呈现上述变化趋势的原因是该反应正反应为放热反应,当温度升高平衡逆向移动,平衡常数(Kp或lnKp)减小;(3) ①利用NaOH干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为CH3OH+NaOH ![]() HCOONa+2H2↑;②阳极CO32-
HCOONa+2H2↑;②阳极CO32-


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】相对分子质量为 M 的气态化合物V L(标准状况),溶于m g 水中,得到质量分数为 w、物质的量浓度为c mol/L、密度为ρg/mL 的溶液,下列说法正确的是
A. 溶液密度ρ=cw/1000M B. 物质的量浓度c=ρV/(MV+22.4m)
C. 溶液的质量分数w=MV/22.4m D. 对分子质量M=22.4mw/(1—w)V
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的流程如下图。
![]()
某化学兴趣小组将上述流程②③设计成如图所示:
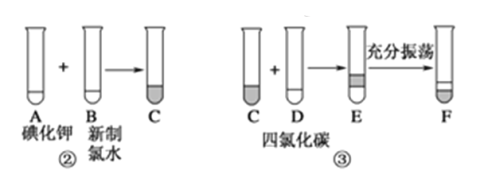
已知②中发生反应的化学方程式为:Cl2+2KI==2KCl+I2。
回答下列问题:
(1)写出提取过程中①③实验操作名称:①________,③________。
(2)F中下层液体的颜色为________色,上层液体中溶质的主要成分为________。从F中得到固态碘还发生反应需进行的操作是______。
(3)用双线桥表示②中的反应电子转移方向和数目:Cl2+2KI==2KCl+I2_______________
(4)提取过程中,消耗标况下Cl256L,碘的提取率为90%,计算能获得碘______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
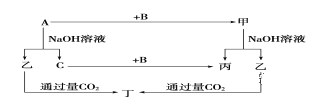
【题目】A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
根据图示转化关系回答:
(1)写出下列物质的化学式。A_______,B___________,乙__________,丁_______。
(2)写出下列变化的方程式。
①A与NaOH溶液反应的化学方程式_______________________。
②甲与NaOH溶液反应生成乙和丙的离子方程式_______________________。
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为________,转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示,下列说法正确的是( )
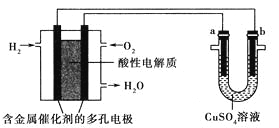
A. 燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B. 电解精炼铜时,若转移1mol电子,a极质量减少32g
C. 铁表面镀铜时,a为铁,b为Cu,工作一段时间要使右池溶液复原可加入适量的CuO
D. 若a、b两极均为石墨时,在相同条件下,a极产生的气体与电池中消耗的O2体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为截取的元素周期表前4周期的一部分,且X、Y、Z、R和W均为主族元素。下列说法正确的是
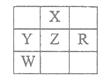
A. 五种元素为原子最外层电子数一定都大于2
B. X、Z原子序数可能相差18
C. Y最高价氧化物的水化物可能是强酸
D. Z的氧化物与X单质不可能发生置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa= -lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。下列说法不正确的是
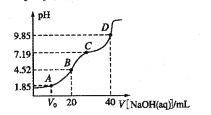
A. A点所得溶液中:Vo等于lOmL
B. B点所得溶液中:![]()
C. C点所得溶液中:![]()
D. D点所得溶液中水解平衡常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com