
| A. | 1molNa与O2完全反应生成Na2O2和Na2O的混合物,转移电子的总数为NA | |
| B. | 室温下,31.0g白磷中含有的共价键数目为1.5NA | |
| C. | 常温常压下,17g甲基(-14CH3)含有的电子数为9NA | |
| D. | 常温下,1.0L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
分析 A.1mol钠完全反应失电子1mol生成1mol+1价钠离子;
B.白磷(分子式为P4)中含有6个P-P共价键,31g白磷中含有0.25mol白磷分子,含有1.5mol共价键;
C.1个甲基(-14CH3)所含的电子数为9;
D.氢氧化钠电离出氢氧根离子,抑制水的电离;
解答 解:A.1mol钠完全反应失电子1mol,生成Na2O和Na2O2的混合物,转移电子总数NA,故A正确;
B.白磷是正四面体型结构,分子中含有6个P-P共价键,31g白磷(分子式为P4)的物质的量是0.25mol,0.25mol白磷分子中含有1.5mol共价键,分子中含有P-P共价键1.5NA,故B正确;
C.常温常压下,17g甲基(-14CH3)的物质的量为1mol,含有9mol电子,所含的电子数为9NA,故C正确;
D.常温下,pH=13的NaOH溶液中,含有的OH-数目为0.1mol,即0.1NA,氢氧化钠电离出氢氧根离子,抑制水的电离,故由水电离的OH-离子数目远小于0.1NA,故D错误;
故答案为:D.
点评 本题考查了阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系;二是要准确弄清分子、原子、原子核内质子中子及核外电子的构成关系,准确把握白磷的结构是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
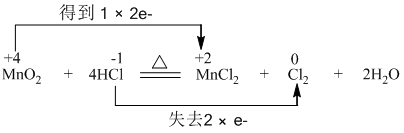
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| z | W | Q |
| A. | Y元素气态氢化物的稳定性大于X元素的气态氢化物 | |
| B. | 形成的简单离子半径:W>Q>Z>X | |
| C. | Q的最高价氧化物对应的水化物酸性最强 | |
| D. | X的最高价氧化物对应的水化物与其氢化物形成的化合物中含有离子键和共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
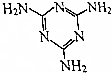 三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )
三聚氰胺的结构式如图所示,尿素[CO(NH2)2]在一定条件下发生分解反应可制得三聚氰胺和CO2等物质,下列说法不正确的是( )| A. | 三聚氰胺的分子式为C3H6N6 | |
| B. | 氰胺的结构简式为H2N-C≡N | |
| C. | 尿素分解制三聚氰胺时,除生成CO2外,还会生成NH3 | |
| D. | 三聚氰胺属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由a形成的单质的熔点都很高 | |
| B. | 各元素的最高化合价的顺序为:c<a=d<b | |
| C. | b分别与a、d均能形成共价化合物 | |
| D. | c的氢化物的还原性比b的氢化物弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  设计铜锌原电池 | B. |  制备氢氧化亚铁并观察其颜色 | ||
| C. | 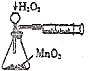 定量测定H2O2的分解速率 | D. | 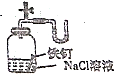 证明铁生锈与空气有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
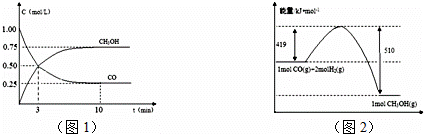
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A. | NaNO3 | CaCO3 | 溶解、过滤、蒸发 |
| B. | FeSO4 | CuSO4 | 加入NaOH溶液,过滤 |
| C. | NaCl溶液 | I2 | 加酒精,萃取分液 |
| D. | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com