
| A. | 50g 98%的硫酸中含有氧原子数目为2NA | |
| B. | 1L0.1 mol•L-1氨水中含有OH-的数目为0.1NA | |
| C. | 标准状况下,22.4L由CCl4和CH2O组成的混合物中含碳原子数目为NA | |
| D. | 常温常压下,足量的Al与1 molCl2共热充分反应后,转移电子数目为2NA |
分析 A.浓硫酸中,溶剂水中含有氧原子,漏掉了水中的氧原子;
B.氨水是弱电解质,在氨水部分电离;
C、气体摩尔体积适用于气体;
D、足量的Al与1 molCl2共热充分反应后,生成氯化铝,1 molCl2得到2mol的电子.
解答 解:A.50g98%的浓硫酸中含有硫酸的质量为50g×98%=49g,硫酸的物质的量为0.5mol,0.5mol硫酸中含有2mol氧原子,由于水中含有氧原子,则该浓硫酸中含有的氧原子大于2mol,所含的氧原子数目大于2NA,故A错误;
B.氨水是弱电解质,在氨水部分电离,所以1L0.1 mol•L-1氨水中含有OH-的数目远小于0.1NA,故B错误;
C、标准状况下,CCl4是液体,所以气体摩尔体积不适用,故C错误;
D、足量的Al与1 molCl2共热充分反应后,生成氯化铝,1 molCl2得到2mol的电子,所以转移电子数目为2NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
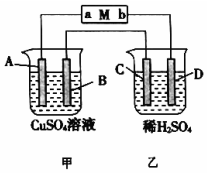 如图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化.回答:
如图所示装置中,当线路接通时,发现M 滤纸(用Na2SO4溶液的石蕊试液浸润过)的a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两电极不发生变化.回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | 纳米铁粉有很好的吸附性 | 纳米铁粉可以高效地去除被污染水体中 的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子 |
| B | 硅胶可以和水发生化学反应 | 硅胶作袋装食品的干燥剂 |
| C | SO3有毒 | 不能做食品防腐剂 |
| D | 肥皂水显碱性 | 肥皂水作蚊虫叮咬处的清洗剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 事 实 | 结 论 | |
| A | HClO与H2SO3反应生成H2SO4和HCl | 非金属性:Cl>S |
| B | N2比白磷稳定得多 | 非金属性:N<P |
| C | 在约800℃时,金属钠可从熔融的KCl中置换出K | 金属性:Na>K |
| D | 工业上电解Na3AlF6和Al2O3的熔融混合物得到Al | 金属活动性:Na>Al |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2既可与NaOH溶液反应也可与HF溶液反应均生成盐和水,所以SiO2属于两性氧化物 | |
| B. | SO2和NH3分别通入水中其水溶液均可以导电,所以SO2和NH3均属于电解质 | |
| C. | “水滴石穿”不仅包含着“量变到质变”的哲学思想,同时也包含了物理和化学变化 | |
| D. | 14CO2和12CO2具有相同的元素组成,所以14CO2、12CO2属于同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液中一定不含K+ | |
| B. | 分液漏斗和容量瓶在使用前都要检漏 | |
| C. | 向某溶液中加人稀盐酸,产生的气体能使澄清石灰水变浑浊,该溶液一定是碳酸盐溶液 | |
| D. | 0.84g铁和50.00 mL 1.00 mol/L的稀硝酸反应,反应后溶液中一定只有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | B. | 气态氢化物的沸点:Y>W | ||
| C. | Y与W可以形成多种二元化合物 | D. | p、q与r的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 L 1.0 mol•L-1 的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 25℃时,10L pH=13的Ba(OH)2溶液中含有的OH-数为2NA | |
| C. | 常温常压下,11g D218O中所含中子数为6NA | |
| D. | 某无水乙醇与足量金属钠反应生成5.6L H2,则该乙醇分子中共价键总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在坩埚中放入NaCl溶液,加热、蒸发得到NaCl晶体 | |
| B. | 用10 mL的量筒量取4.8 mL的盐酸 | |
| C. | 用托盘天平称取25.20 g NaCl | |
| D. | 用1000 mL容量瓶配制450 mL 0.1 mol•L-1的盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com