
分析 (1)计算出硫酸铜晶体中含有硫酸铜和水的质量,从而得出饱和溶液中溶质和溶剂的质量,然后根据S=$\frac{{m}_{溶质}}{{m}_{溶剂}}$×100g计算出20℃时CuSO4的溶解度;
(2)析出硫酸铜晶体后的溶液仍然为饱和溶液,则析出的硫酸铜晶体与蒸发出的10g水混合后也是饱和溶液,设析出硫酸铜晶体的质量为x,利用该温度下的溶解度列式计算即可.
解答 解:(1)31.25g CuSO4•5H2O中含有硫酸铜的质量为:31.25g×$\frac{160}{250}$=20g,含有水的质量为:31.25g-20g=11.25g,则饱和溶液中溶剂的总质量为:88.75g+11.25g=100g,
所以20℃时CuSO4的溶解度为:S=$\frac{20g}{100g}$×100g=100g,
答:20℃时CuSO4的溶解度为20g;
(2)若将该溶液蒸发掉10g水后仍降温至20℃,剩余的溶液仍然为饱和溶液,则析出的硫酸铜晶体与蒸发出的10g水混合后也是饱和溶液,
设析出的硫酸铜晶体的质量为x,其中含有硫酸铜的质量为:xg×$\frac{160}{250}$=$\frac{16}{25}$xg,硫酸铜晶体中含有水的质量为:$\frac{9}{25}$xg,水的总质量为:10g+$\frac{9}{25}$xg,
则一定满足:$\frac{\frac{16}{25}xg}{10g+\frac{9}{25}xg}$=$\frac{20}{100}$,
解得:x=3.52g,
答:若将该溶液蒸发掉10g水后仍降温至20℃,可析出CuSO4•5H203.52g.
点评 本题考查了溶解度的计算,题目难度中等,明确溶解度的概念及计算方法为解答关键,注意硫酸铜晶体中含有溶剂水,而溶质为硫酸铜,为易错点,试题培养了学生的化学计算能力.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:选择题
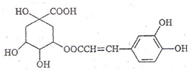
| A. | 分子式为C16H18O9 | |
| B. | 在一定条件下能发生消去反应 | |
| C. | 1mol咖啡鞣酸水解时可消耗8molNaOH | |
| D. | 与浓溴水既能发生取代反应又能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
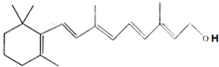 ,关于它的叙述正确的是( )
,关于它的叙述正确的是( )| A. | 维生素A1是一种易溶于水的醇 | |
| B. | 维生素A1分子中含有苯环结构 | |
| C. | 维生素A1能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,且原理相同 | |
| D. | 1mol维生素A1在催化剂作用下,最多与5molH2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下达到化学平衡时,N2、H2和NH3的物质的量浓度之比为1:3:2 | |
| B. | 达到化学平衡时,N2完全转化为NH3 | |
| C. | 达到化学平衡时,正反应和逆反应速率相等,且都为零 | |
| D. | 单位时间内消耗amolN2同时消耗2amolNH3,说明该反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
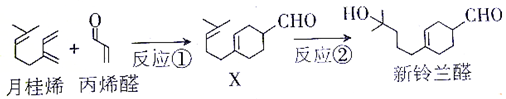
| A. | 反应①属于加成反应 | |
| B. | 新铃兰醛能发生消去反应 | |
| C. | 检验新铃兰醛中是否混有醛X,可用溴水 | |
| D. | 1mol新铃兰醛完全燃烧需消耗17.5mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
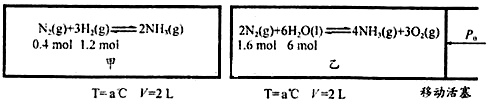
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O (l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O (l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+1/2O2(g)═H2O (l)△H=-285.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油不能使溴的四氯化碳溶液褪色 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 葡萄糖能发生氧化反应和水解反应 | |
| D. | 硬脂酸甘油脂的相对分子质量为890,故其属于高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com