
【题目】100 mL 2 mol/L H2SO4与过量Zn粉反应,在一定温度下,为了加快反应速率,但又不影响生成氢气的总量,可以采取的措施是( )
A. 加入碳酸钠固体
B. 改用18 mol/L的浓H2SO4
C. 滴入少量硫酸铜溶液
D. 加入硫酸钾溶液
科目:高中化学 来源: 题型:
【题目】下列事实,不能说明氯元素的非金属性比硫元素强的是:
A. 氯气与H2S能发生置换反应 B. HClO4酸性比H2SO4强
C. 盐酸是强酸,氢硫酸是弱酸 D. 受热时,氯化氢比硫化氢稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源库,下列有关海水综合利用的说法错误的是
A.海水中含有溴元素,需经过化学变化才可以得到溴单质
B.无论是海水波浪发电还是潮汐发电,都是将化学能转化为电能
C.从海水中可以得到NaCl电解熔融NaCl可制备金属钠
D.从海水中提取镁可以采用下列方法:海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2→MgCl2(熔解)
MgCl2溶液→MgCl2→MgCl2(熔解)![]() Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中一定能大量共存的离子组是( )
A.Mg2+、Na+、Cl﹣、NO3﹣ B.K+、H+、NO3﹣、HCO3﹣
C.Ba2+、K+、OH﹣、SO42﹣ D.OH﹣、Al3+、Ag+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、H2O、N2和 。
(2)为检验分解产物的成份,设计如图所示实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
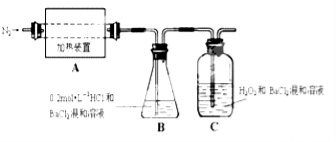
①A中固体充分加热较长时间后,通入氮气,目的是 。
②为验证A中残留物是否含有FeO,需要选用的试剂有 。
A.KSCN溶液
B.稀硫酸
C.浓盐酸
D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有 气体生成,若含有该气体,观察到的现象为 。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为bmol,C中沉淀物质的量为amol,则
b a(填“大于”、“小于”或“等于”)
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为 (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,且必不可少的化学元素是
A. Fe、Mn、Zn、Mg B. Zn、Cu、Mn、Ca
C. H、O、Na、Mg D. Zn、Cu、B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质R完全燃烧的化学方程式为:2R+3O2 ![]() 2CO2 + 4H2O 有关该反应,有下列说法:
2CO2 + 4H2O 有关该反应,有下列说法:
①R一定含碳、氢两种元素,可能含有氧元素
②R中碳元素的质量分数是37.5 %
③6.4g R完全燃烧,转移1.2NA个电子
④R的摩尔质量为32
若6.4 g R完全燃烧生成8.8 g CO2,则正确的一组是
A.① ② B. ③④ C.②④ D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、有A、B、C三种可溶性盐,阴、阳离子各不相同,其阴离子的摩尔质量按A、B、C的顺序依次增大。将等物质的量的A、B、C溶于水,所得溶液中只含有Fe3+、NH4+、SO![]() 、NO
、NO![]() 、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
、Cl-五种离子,同时生成一种白色沉淀。请回答下列问题:
(1)经检验,三种盐中还含有下列选项中的一种离子,该离子是____________。
A. Na+ B.Ba2+ C.Mg2+ D. Cu2+
(2)写出C的化学式:C____________。
(3)若将A、B、C三种盐按一定比例溶于水,所得溶液中只含有Fe3+、Cl-、NO![]() 、NH4+四种离子且物质的量之比依次为1∶1∶3∶1(不考虑水电离的影响)。则A、B、C三种盐的物质的量之比为____________。若向B溶液中通入少量SO2气体,有沉淀和无色气体产生,该沉淀为 。
、NH4+四种离子且物质的量之比依次为1∶1∶3∶1(不考虑水电离的影响)。则A、B、C三种盐的物质的量之比为____________。若向B溶液中通入少量SO2气体,有沉淀和无色气体产生,该沉淀为 。
II、已知某KNO3溶液A中,混有少量的Ca2+和SO![]() 等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体。
等杂质,某同学设计了如下实验方案以制得纯净的KNO3固体。

根据上述回答:
(1)沉淀D中所含有的物质是 。
(2)按上述实验方案制得的KNO3晶体,经分析测定仍含有杂质,其原因是上述第 步(填① ② ③)可能有误,请加以改正: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成。B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为
A.离子键B.极性共价键C.非极性共价键D.氢键
(2)下表为B与F实验的部分内容
①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出B与稀H2SO4反应的离子方程式
写出②中反应的化学方程式
(3).现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子),XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1molMnO4-需氧化剂的物质的量为mol
(4).化合物D和E相互转化D![]() E,若有D和E·
E,若有D和E·![]() H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E·
H2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增重2.20g,则混合物中D的质量为g,E·![]() H2O的化学式为
H2O的化学式为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com