
 ,CH3CH═CH2$→_{500℃}^{Cl_{2}}$
,CH3CH═CH2$→_{500℃}^{Cl_{2}}$ .以异戊二烯(
.以异戊二烯( 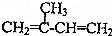 ),丙烯为原料合成
),丙烯为原料合成 .(用反应流程图表示,并注明反应条件)
.(用反应流程图表示,并注明反应条件) 科目:高中化学 来源: 题型:多选题
| A. | 苏打与稀盐酸反应:HCO3-+H+═CO2↑+H2O | |
| B. | Fe2O3与HI:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 向NH4Al(SO4)2溶液中滴加Ba(OH)2 溶液至SO42-刚好完全沉淀:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Al(OH)3↓ | |
| D. | 向NaClO溶液中通入少量SO2:SO2+ClO-+H2O═SO42-+Cl-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶度积(Ksp) | 2.2×10-20 | 8.0×10-16 | 4.0×10-38 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 不能氧化为氧化成醛或酸
不能氧化为氧化成醛或酸
 PMAA
PMAA
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O;
+2H2O; $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3、NaCl、Na2SO4、NaI | B. | Na2SO4、KNO3、(NH4)2SO4、MgCl2 | ||
| C. | FeCl3、NaOH、NaCl、NaNO3 | D. | NaCl、HCl、NaAlO2、NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加了3.0g | B. | 减少了3.0g | C. | 增加了2.6g | D. | 减少了2.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com