
| A、氧化镁、氧化铝的熔点都很高,都可用作耐高温材料 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、品红溶液通入二氧化硫,品红褪色,再加热不恢复红色 |
| D、锌的金属活泼性比铁强,可在海轮外壳上装若干锌块以减缓其腐蚀 |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| A、③⑤⑥⑦⑧ | B、②③④⑥⑦ |
| C、③⑥⑧ | D、①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
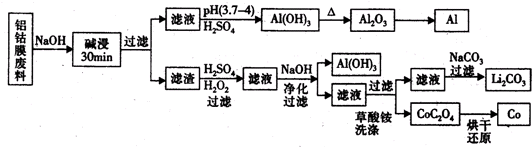
查看答案和解析>>
科目:高中化学 来源: 题型:
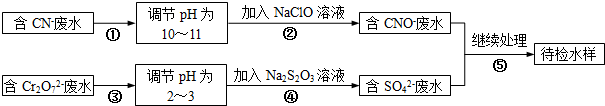
查看答案和解析>>
科目:高中化学 来源: 题型:
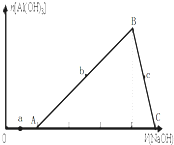 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )| A、在a点对应的溶液中,加入Mg2+、I-、NH4+、NO3-离子仍能大量共存 |
| B、原溶液中盐酸和AlCl3物质的量的浓度之比为1:3 |
| C、若b、c的纵坐标数值相同,则横坐标数值之比为1:3 |
| D、图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
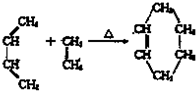
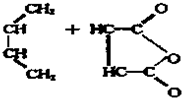
| △ |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
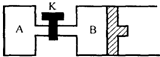 如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.
如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com