
【题目】有A、B、C三种常见的短周期元素,它们的原子序数逐渐增大。A元素原子最外层电子数是次外层电子数的2倍,B元素原子最外层电子数等于其电子层数,且为C元素原子最外层电子数的一半。甲为含B的钠盐,乙为C的最高价氧化物对应的水化物,丙为含A的钠盐。 甲、乙、丙、丁四种物质之间的相互反应关系如下图:
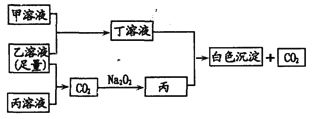
请回答:
(1)写出Na2O2的电子式___________;C在周期表中的位置____________。
(2)用有关化学用语解释丙溶液呈碱性的原因___________________________。
(3)写出甲溶液与足量乙溶液反应的离子方程式: ________________________。
(4)丙和丁因发生双水解而不能共存写出该反应的离子方程式:_____________。
【答案】![]() 第三周期 ⅥA族 CO32-+H2O
第三周期 ⅥA族 CO32-+H2O![]() HCO3-+OH- 4H++AlO2―= Al3++2H2O 2Al3++3CO32-+3H2O= 2Al(OH)3↓+3 CO2↑
HCO3-+OH- 4H++AlO2―= Al3++2H2O 2Al3++3CO32-+3H2O= 2Al(OH)3↓+3 CO2↑
【解析】
A元素原子最外层电子数是次外层电子数的2倍,即A为C,B元素最外层电子数等于其电子层数,三种元素原子序数依次增大,则B为Al,Al的最外层电子式为C原子最外层电子数一半,则C为S,甲为含B的钠盐,即甲为NaAlO2,乙为C的最高价氧化物对应的水化物,则C为H2SO4,丙为含A的钠盐,丙可能为Na2CO3或NaHCO3,然后根据转化关系进行分析即可。
A元素原子最外层电子数是次外层电子数的2倍,即A为C,B元素最外层电子数等于其电子层数,三种元素原子序数依次增大,则B为Al,Al的最外层电子式为C原子最外层电子数一半,则C为S,甲为含B的钠盐,即甲为NaAlO2,乙为C的最高价氧化物对应的水化物,则C为H2SO4,丙为含A的钠盐,丙可能为Na2CO3或NaHCO3,根据转化关系CO2与Na2O2反应生成丙,即丙为Na2CO3,(1)过氧化钠的电子式为![]() ;C为S,位于第三周期VIA族;(2)根据上述分析,丙为Na2CO3,属于强碱弱酸盐,溶液显碱性,是因为CO32-的水解造成, CO32-+H2O
;C为S,位于第三周期VIA族;(2)根据上述分析,丙为Na2CO3,属于强碱弱酸盐,溶液显碱性,是因为CO32-的水解造成, CO32-+H2O![]() HCO3-+OH-;(3)氢氧化铝为两性氢氧化物,NaAlO2溶液中加入过量的H2SO4,离子反应方程式为AlO2-+4H+=Al3++2H2O;(4)根据上述分析,丁溶液为Al2(SO4)3,Al3+和CO32-发生双水解反应,其离子反应方程式为2Al3++3CO32-+3H2O= 2Al(OH)3↓+3CO2↑。
HCO3-+OH-;(3)氢氧化铝为两性氢氧化物,NaAlO2溶液中加入过量的H2SO4,离子反应方程式为AlO2-+4H+=Al3++2H2O;(4)根据上述分析,丁溶液为Al2(SO4)3,Al3+和CO32-发生双水解反应,其离子反应方程式为2Al3++3CO32-+3H2O= 2Al(OH)3↓+3CO2↑。


科目:高中化学 来源: 题型:
【题目】25℃时,用0.100 mol·L-1盐酸分别滴定20.00 mL 0.100 mol·L-1的氨水和20.00 mL 0.100 mol·L-1NaOH溶液,两溶液的pH与所加盐酸体积(V)的关系如图所示。下列说法正确的是 ( )
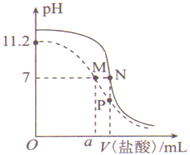
A. Kb(NH3·H2O)的数量级为10—4
B. 10 < a < 20
C. P点溶液中:c(NH4+)>c(Cl一)
D. 水的电离程度:M > N > P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下五种有色溶液与SO2作用,能褪色且其实质相同的是( )
①滴有石蕊的NaOH溶液 ②氯水 ③酸性KMnO4溶液 ④品红溶液 ⑤碘和淀粉的混合物
A.①④B.①②③C.②③④D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取少量NaHSO3的实验装置如图所示:
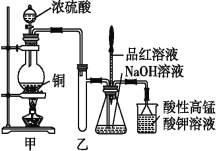
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4是否剩余?______,原因是_____________。
①下列药品中,能够证明反应后烧瓶中有硫酸剩余的是_______。
A.Fe粉 B.BaCl2溶液 C.Ag D.饱和NaHSO3溶液
②当向甲中反应后的溶液中通入氧气,发现铜片全部溶解,且仅生成硫酸铜溶液,则该反应的离子方程式为__________。
(2)装置乙的作用是______________。
(3)请写出铜与浓硫酸反应的化学方程式:______。
(4)下列说法正确的是_____(填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.酸性KMnO4溶液用于尾气处理
c.当把品红溶液滴入锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A. 0.1 mol·L-1 CH3COONa溶液与0.1 mol·L-1 CaCl2溶液等体积混合:c(Na+) + 2c(Ca2+) = c(CH3COO-) + c(CH3COOH) + 2c(Cl-)
B. 浓度均为0.1 mol·L-1的小苏打溶液与烧碱溶液等体积混合:c(OH-)-c(H+) = c(HCO) + c(H2CO3)
C. pH相同的氨水、KOH溶液、Ba(OH)2溶液中:2c(NH![]() ) = 2c(K+) = c(Ba2+)
) = 2c(K+) = c(Ba2+)
D. 常温下,0.2 mol·L-1 NH4NO3溶液与0.1 mol·L-1 NaOH溶液等体积混合,所得pH=9.6的溶液中:c(NO)>c(NH4+)>c(Na+)>c(NH3·H2O)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从香荚兰豆中提取的一种芳香化合物,其分子式为C8H8O3,遇FeCl3溶液会呈现特征颜色,能发生银镜反应。该化合物可能的结构简式是( )
A. 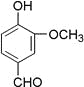 B.
B. 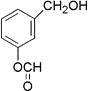 C.
C. 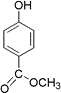 D.
D. 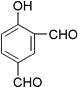
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 1mol FeCl3完全转化为Fe(OH)3 胶体后生成NA个胶体粒子
B. 1.8g的NH4+中含有的电子数为NA
C. 常温常压下,32g O2和O3的混合气体中所含原子数为1.5NA
D. 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)写出表示含有8个质子、10个中子的原子的化学符号:________;
(2)32号元素在元素周期表中的位置___________________;
(3)在N2、H2S、NaCl、NH4Cl、Na2O2、H2O2中,既含有离子键又含有极性键的是________________ ,既含有离子键又含有非极性键的是______________;
(4) A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两种元素的原子核外电子数之和等于B原子的质子数,请回答下列问题:
![]()
写出A、B、C三种元素的符号:A_______,B________,C________;B在周期表中位置是 __________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A. 在元素周期表的金属和非金属分界线附近寻找半导体材料
B. “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化
C. “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
D. 氢氧燃料电池是一种能量转换率较高、符合绿色化学理念的新型动力能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com