
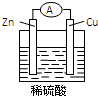
 Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑.
Zn-Cu-H2SO4原电池的负极材料是Zn,正极反应式是2H++2e-═H2↑,发生还原反应反应(填反应类型),总反应式为Zn+H2SO4═ZnSO4+H2↑. 科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电离方程式:HClO?H++ClO- | |
| B. | 铝溶于烧碱溶液的离子方程式:Al+2OH-═AlO2-+H2↑ | |
| C. | 电解精炼铜的阴极反应式:Cu-2e-═Cu2+ | |
| D. | 已知中和热为57.3 kJ•mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4 (aq)+2NaOH (aq)═Na2SO4 (aq)+2H2O ( l )△H=+114.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有SO32-离子 | B. | 不一定有CO32-离子 | ||
| C. | 不能确定Cl-离子是否存在 | D. | 不能确定HCO3-离子是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某离子结构示意图为: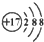 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式为: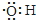 ,可以表示羟基,也可以表示氢氧根离子 ,可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型为: ,可以表示甲烷分子,也可以表示四氯化碳分子 ,可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 晶体锗的结构为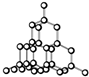 ,其晶胞可表示为 ,其晶胞可表示为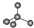 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2与HCl加成 | |
| B. | C6H5-CH3在铁粉存在下与氯气反应 | |
| C. | CH3-CH2-CHBr-CH3在氢氧化钠乙醇溶液中加热反应 | |
| D. | CH3-CHOH-CH3在浓硫酸存在下,发生分子内脱水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子有得失 | B. | 共用电子对有偏移 | ||
| C. | 电子既有得失又有电子对偏移 | D. | 含有多种非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com