
向某密闭容器中加入0.3mol A、0.1mol C和一定量的气体B三种气体,在一定条件下发生反应,各物质浓度随时间变化如下面左图所示。下面右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况且t2—t5四个阶段都各改变一种条件,所用条件均不同。t3—t4阶段为使用催化剂。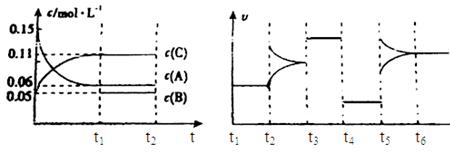
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率为v(C)= mol/(L?s);
(2)若t2—t3阶段,C的体积分数变小,此阶段v正 v逆(填“大于”、“小于”或“等于”)
(3)B的起始物质的量为 mol;
(4)t1时刻,平衡常数K= ;
(5)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为a KJ,写出该反应的热化学方程式 ;
(6)若t2时刻后图像变化如下图,则改变条件为 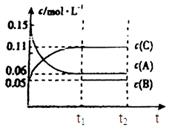
a.恒温恒压下,按照2:1比例充入任意量的B和C
b.恒温恒压下,加入0.24mol A、0.06mol B和0.14mol C
c.恒温恒压下,加入0.12mol A、0.1mol B和0.22mol C
d.恒温恒压下,加入0.14mol B和0.30mol C
(1)0.004(2)小于(3)0.04(4)2.80
(5)3A(g) B(g)+2C(g) ΔH=+100a kJ?mol-1(6)bd
B(g)+2C(g) ΔH=+100a kJ?mol-1(6)bd
解析试题分析:(1)若t1=15s,生成物C在t0~t1时间段的平均反应速率v= =
= mol/(L?s)=0.004mol/(L?s);(2)由题意知,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g)
mol/(L?s)=0.004mol/(L?s);(2)由题意知,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,则该反应中气体的化学计量数之和前后相等,则有:3A(g) B(g)+2C(g),若t2—t3阶段,C的体积分数变小,说明反应向逆反应方向进行,则v正<v逆;(3)根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为
B(g)+2C(g),若t2—t3阶段,C的体积分数变小,说明反应向逆反应方向进行,则v正<v逆;(3)根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为 =2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol;(4)在t1时刻,c(A)=0.06 mol/L,c(B)=0.05 mol/L,c(C)=0.11 mol/L,故平衡常数K=
=2L,生成B的物质的量为0.03mol/L×2L=0.06mol,平衡时B的物质的量为0.05mol/L×2L=0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol;(4)在t1时刻,c(A)=0.06 mol/L,c(B)=0.05 mol/L,c(C)=0.11 mol/L,故平衡常数K= =
= =2.80;(5)反应的方程式为3A(g)
=2.80;(5)反应的方程式为3A(g) B(g)+2C(g),A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为100akJ,根据图象可知t5~t6阶段应为升高温度,A的物质的量减少,说明反应向正反应方向移动,则正反应吸热,故该反应的热化学方程式为3A(g)
B(g)+2C(g),A的物质的量减少0.03mol,而此过程中容器与外界的热交换总量为akJ,则A的物质的量减少3mol,与外界的热交换总量为100akJ,根据图象可知t5~t6阶段应为升高温度,A的物质的量减少,说明反应向正反应方向移动,则正反应吸热,故该反应的热化学方程式为3A(g) B(g)+2C(g),△H=+100akJ?mol-1;(6)恒温恒压下反应图像变化达到平衡,一种反应速率瞬间减小,一种瞬间增大,最后达到平衡,3A(g)
B(g)+2C(g),△H=+100akJ?mol-1;(6)恒温恒压下反应图像变化达到平衡,一种反应速率瞬间减小,一种瞬间增大,最后达到平衡,3A(g) B(g)+2C(g),则a不符,d符合,c不符,b符合
B(g)+2C(g),则a不符,d符合,c不符,b符合
考点:物质的量或浓度随时间的变化曲线;化学反应速率与化学平衡图象的综合应用


科目:高中化学 来源: 题型:填空题
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示: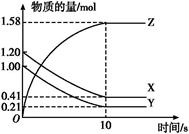
(1)从反应开始到10 s时,用Z表示的反应速率为 ,X的物质的量浓度减少了 ,Y的转化率为 。
(2)该反应的化学方程式为
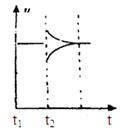
(3)10 s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示: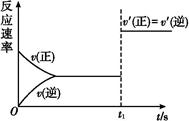
则下列说法符合该图像的是 。
| A.t1时刻,增大了X的浓度 | B.t1时刻,升高了体系温度 |
| C.t1时刻,缩小了容器体积 | D.t1时刻,使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s) yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题: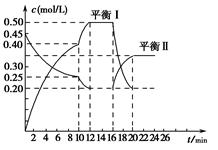
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金属镁及其化合物不仅在国防上有重要应用,在化学研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:取一段镁条,用砂纸擦去表面的氧化膜,使足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图所示。镁与盐酸反应的离子方程式为 ;在前4min内,镁条与盐酸的反应速率逐渐加快,在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
(1)将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为: SO42-+ Ca(OH)2(s)+2H2O CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH="12.3" [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
(2)在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_______________________________________________________________。
(3)添加的酸性物质须满足的条件(写出两点)是_____________、______________。
(4)用平衡移动原理解释添加酸性物质的理由:____________________________________;以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
(5)Na2CO3溶液中存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小
b.通入CO2,溶液pH减小
c.加入NaOH固体,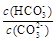 减小
减小
d.稀释溶液,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
 2CO(g)平衡常数K;K的表达式 ;
2CO(g)平衡常数K;K的表达式 ; CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1; H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2; 2CO(g)能判断该反应达到化学平衡状态的依据是________。
2CO(g)能判断该反应达到化学平衡状态的依据是________。 2CO(g),并维持反应过程中温度不变。已知甲容器中
2CO(g),并维持反应过程中温度不变。已知甲容器中
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮气与氢气反应生成氨气的平衡常数见下表:
| | N2+3H2 2NH3 2NH3 | |||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 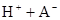 | 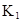 | 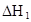 |  |
在苯中,2HA 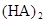 | 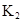 | 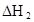 | 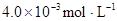 |
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则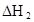 ___________0。
___________0。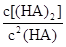 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为减少污染,常将煤转化为清洁气体燃料,可将焦炭与水蒸气反应转化为氢气和一氧化碳:C(s)+ H2O(g)  H2(g)+ CO(g)
H2(g)+ CO(g) 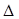 H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
(1)用H2O(g)表示反应开始到达到平衡的平均速率 ;
(2)计算T℃下该反应的平衡常数K= ;若温度升高,则反应平衡常数将 (填“增大”“减小”或“不变”)。
(3)上述条件下该反应达到平衡状态,下列说法正确的是
| A.缩小容器体积,平衡向左移动 | B.加入催化剂,CO的产率增大 |
| C.增加碳的量,H2O(g)的转化率增大 | D.降低温度,H2O(g)的转化率降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com