
| 化学性质 | 实际应用 | |
| A | Al2(SO4)3和小苏打反应 | 泡沫灭火器灭火 |
| B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
| D | HF与SiO2反应 | 氢氟酸在玻璃器皿上刻蚀标记 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Al2(SO4)3和小苏打在溶液中发生互促水解反应,可生成二氧化碳气体;
B.氯化铁具有强氧化性,可与铜反应;
C.次氯酸盐具有强氧化性,可用于漂白;
D.玻璃含有二氧化硅,HF与SiO2反应.
解答 解:A.Al2(SO4)3水解呈酸性,小苏打水解呈碱性,在溶液中二者发生互促水解反应,可生成二氧化碳气体,可用于泡沫灭火器灭火,故A正确;
B.氯化铁具有强氧化性,可与铜反应,与铁、铜的活泼性无关,故B错误;
C.次氯酸盐具有强氧化性和漂白性,可用于漂白,故C正确;
D.玻璃含有二氧化硅,HF与SiO2反应生成SiF4,氢氟酸可用于雕刻玻璃,故D正确.
故选B.
点评 本题综合考查元素化合物知识,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
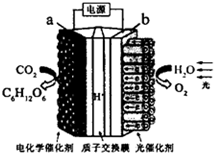
| A. | a极与电源的正极相连 | |
| B. | 该装置能量转化形式仅为电能转化为化学能 | |
| C. | 阳极反应为 6COz+24H+-24e-=C6Hl206+6H20 | |
| D. | 电解后阳极区溶液的pH不变(忽略体积影响) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
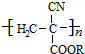 从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下:
从而具有胶黏性.某种氰基丙烯酸酯(G)的合成路线如下: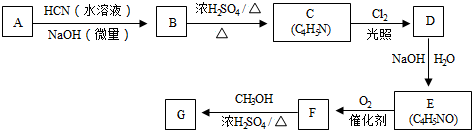
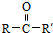 $→_{NaOH(微量)}^{HCN(水溶液)}$
$→_{NaOH(微量)}^{HCN(水溶液)}$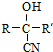
 .其核磁共振氢谱显示为2组峰,峰面积比为1:6.
.其核磁共振氢谱显示为2组峰,峰面积比为1:6. +NaOH$→_{△}^{水}$
+NaOH$→_{△}^{水}$ +NaCl.
+NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气作水的杀菌消毒剂 | B. | 硅胶作袋装食品的干燥剂 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 肥皂水作蚊虫叮咬处的清洗剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气比臭氧稳定 | |
| B. | 所有吸热反应不一定都要加热反应才能进行 | |
| C. | 断裂3mol氧气中的化学键吸收的能量大于形成2mol臭氧中的化学键放出的能量 | |
| D. | 3mol氧气的总能量比2mol臭氧的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
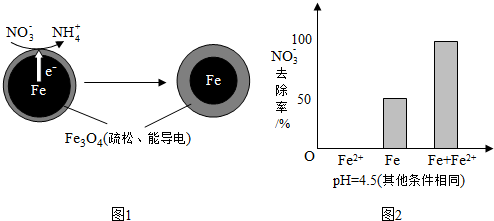
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 接近100% | <50% |
| 24小时pH | 接近中性 | 接近中性 |
| 铁的最终物质形态 | 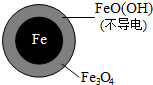 |  |
| 初始pH | pH=2.5 | pH=4.5 |
| NO3-的去除率 | 约10% | 约3% |
| 1小时pH | 接近中性 | 接近中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com