
【题目】丹参素(I)是一种具有改善心脏功能、抗血栓形成、促进组织的修复与再生等多种作用的药物。该药物的一种合成路线如下:
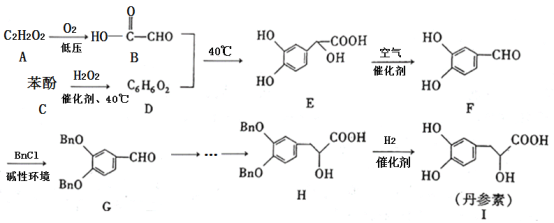
已知:![]() 代表苄基(
代表苄基(![]() )
)
请回答下列问题:
(1)![]() 的结构简式为_______,
的结构简式为_______,![]() 中所含官能团的名称为羟基、______。
中所含官能团的名称为羟基、______。
(2)![]() 的反应类型为_______,该反应的目的是________。
的反应类型为_______,该反应的目的是________。
(3)写出![]() 的化学方程式:________。
的化学方程式:________。
(4)苯酚与![]() 反应可以制备物质
反应可以制备物质![]() (
(![]() )。
)。![]() 是
是![]() 的同系物,相对分子质量比
的同系物,相对分子质量比![]() 大14。则符合下列条件的
大14。则符合下列条件的![]() 的同分异构体有______种(不考虑立体异构)。
的同分异构体有______种(不考虑立体异构)。
①苯环上只有两个取代基 ②能与![]() 溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
溶液发生显色反应 ③能发生银镜反应 ④红外光谱表明分子中不含醚键
其中核磁共振氢谱有6组峰,且峰面积之比为![]() 的结构简式为________(写出一种即可)。
的结构简式为________(写出一种即可)。
(5)参照丹参素的上述合成路线,以![]() 为原料,设计制备
为原料,设计制备![]() 的合成路线:____________。
的合成路线:____________。
【答案】 羧基、醚键 取代反应 保护酚羟基
羧基、醚键 取代反应 保护酚羟基 ![]() 18
18 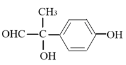 或
或
![]()
【解析】
根据合成路线分析可知,A(C2H2O2)在低压的条件下氧化生成B(![]() ),则A的结构简式为OHC—CHO,C(苯酚)与H2O2加催化剂、在40℃时反应生成D,D与B在40℃发生取代反应生成E,则D的结构简式为
),则A的结构简式为OHC—CHO,C(苯酚)与H2O2加催化剂、在40℃时反应生成D,D与B在40℃发生取代反应生成E,则D的结构简式为 ,E与空气催化反应生成F,F与BnCl在碱性环境下发生取代反应生成G,G经一系列反应生成H,H在催化剂的条件下与H2发生还原反应生成丹参素I,据此分析解答。
,E与空气催化反应生成F,F与BnCl在碱性环境下发生取代反应生成G,G经一系列反应生成H,H在催化剂的条件下与H2发生还原反应生成丹参素I,据此分析解答。
(1)根据上述分析可知,D的结构简式为 ,H的结构简式为
,H的结构简式为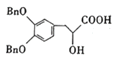 ,分子中含有羟基、羧基、醚键,故答案为:
,分子中含有羟基、羧基、醚键,故答案为: ;羧基、醚键;
;羧基、醚键;
(2)F与BnCl在碱性环境下发生取代反应生成G,可保护酚羟基,故答案为:取代反应;保护酚羟基;
(3)A(C2H2O2)在低压的条件下氧化生成B(![]() ),反应方程式为
),反应方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(4由题干信息,N为M的同系物,相对分子质量比M大14,则N比M多一个CH2,N能与FeCl3溶液发生显色反应,且能发生银镜反应,则分子中含有酚羟基和醛基,又苯环上只有两个取代基,且红外光谱表明分子中不含醚键,则苯环上的两个基团可以为:①—OH、—CH2CH2OOCH②—OH、—CH(CH3)OOCH③—OH、—CH2CH(OH)CHO④—OH、—CH(OH)CH2CHO⑤—OH、 ⑥—OH、—CH(CHO)CH2OH,苯环上两个取代基有邻间对3种结构,则N的同分异构体共有3×6=18种,其中核磁共振氢谱有6组峰,且峰面积之比为
⑥—OH、—CH(CHO)CH2OH,苯环上两个取代基有邻间对3种结构,则N的同分异构体共有3×6=18种,其中核磁共振氢谱有6组峰,且峰面积之比为![]() 的结构简式为
的结构简式为 或
或 ,故答案为:18;
,故答案为:18; 或
或 ;
;
(5)根据上述合成路线,以![]() 为原料,制备
为原料,制备![]() 时,可先将
时,可先将![]() 在碱性环境下与BnCl发生取代反应生成
在碱性环境下与BnCl发生取代反应生成![]() ,
,![]() 氧化生成
氧化生成![]() ,最后
,最后![]() 加催化剂被H2还原生成
加催化剂被H2还原生成![]() ,故合成路线可设计为:
,故合成路线可设计为:![]() 。
。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)=
Ba(OH)2(aq)=![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】84消毒液、酒精、过氧乙酸等消毒剂在抗击新型冠状病毒肺炎疫情中起到重要作用。回答下列问题:
Ⅰ.84消毒液是北京第一传染病医院(现北京地坛医院)于1984年研制的一种消毒液,主要成分为受热易分解的次氯酸钠(NaClO)。某实验小组用如图装置制备84消毒液。
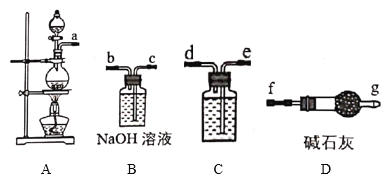
(1)A中发生反应的离子方程式为___。
(2)C中盛装试剂为__,仪器的连接顺序为a→__。
(3)制备84消毒液时,若Cl2与NaOH溶液反应温度过高,NaClO的产率将__(填“增大”“减小”或“不变”)。
Ⅱ.过氧乙酸(CH3COOOH)是无色液体,易溶于水,有强烈刺激性气味,有腐蚀性,对人的眼睛、皮肤、黏膜、上呼吸道等有强烈刺激作用,易分解,易爆炸。
(4)贮存和运输CH3COOOH时要注意的事项是__。
(5)消毒过程中需将200mL20%的过氧乙酸(密度为1.02g·cm-3)稀释为0.5%的过氧乙酸,则需加入水的体积为__![]() 。
。
(6)CH3COOOH可用H2O2和CH3COOH制备,其化学方程式为___。
(7)制备CH3COOOH过程中总会残留少量H2O2,因此CH3COOOH在使用过程中需要准确标定原液的浓度。取CH3COOOH样品![]() ,标定步骤如下:
,标定步骤如下:
a.用KMnO4标准溶液滴定H2O2;
b.当达到终点时加入足量KI溶液,发生反应:2KI+H2SO4+CH3COOOH=2KHSO4+CH3COOH+H2O+I2;
c.用1.500mol·L-1Na2S2O3标准溶液滴定生成的I2,发生反应:I2+2Na2S2O3=2NaI+Na2S4O6,消耗Na2S2O3溶液20.00mL。
测得样品中CH3COOOH的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol·L-1的氢氧化钠溶液,生成的沉淀跟加入的氢氧化钠溶液的体积关系如图(横坐标体积单位是mL,纵坐标质量单位是g)。
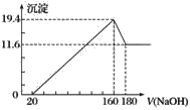
(1)合金中镁的质量是__________。
(2)所用盐酸的物质的量浓度是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是

A. A处通入空气,B处通入水煤气
B. a电极的反应式包括:CO+4OH--2e-= CO32-+2H2O
C. a电极发生还原反应,b电极发生氧化反应
D. 如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
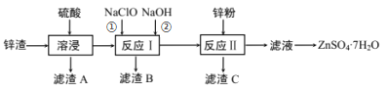
(1)“溶浸”操作中,写出加快“锌渣”“溶浸”速率的两种措施_____________。
(2)“滤渣A”的主要成分是________;“滤渣C”的主要成分是________。
(3)“反应Ⅰ”中①,先加入NaClO反应的离子方程式为____________;“反应Ⅰ”中②,再加入NaOH调节溶液pH约为_________,则滤液中Fe元素浓度小于4×105mol·L-1,而基本存在于“滤渣B”中。(Ksp[Fe(OH)3]=4×1038)
(4)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(5)在实验室中,由滤液获得ZnSO4·7H2O晶体的具体实验操作有_____________。
(6)取28.7g ZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.ZnSO4 C. Zn3O(SO4)2 D.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示:
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
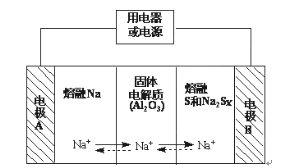
(1)请判断该电池工作的适宜温度应控制在____范围内(填字母序号)。
A.常温 B.60℃~ 100℃ C.200℃~350℃ D.2000℃~3000℃
(2)放电时,电极A为___极。
(3)放电时,内电路中Na+的移动方向为___(填“从A到B”或“从B到A”)。
(4)充电时,总反应为Na2Sx=2Na+xS(3<x<5),则阳极的电极反应式为___。
Ⅱ、用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
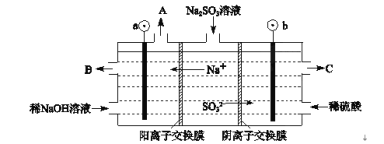
(1)图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___。
(2)SO32-放电的电极反应式为____。
(3)电解过程中阴极区碱性明显增强,请结合电极方程式解释原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、![]() 、Cl-中的一种或几种,为鉴别其中所含离子,现进行如下实验:
、Cl-中的一种或几种,为鉴别其中所含离子,现进行如下实验:

请回答下列问题:
(1)原溶液中一定存在的离子是______(填离子符号,下同),一定不存在的离子是______________,可能存在的离子是__________________。
(2)为进一步确定原溶液中可能存在的离子是否存在,应进行的实验操作及判断依据是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。
(1)参加反应的HNO3和作为氧化剂的HNO3的个数比为________。
(2)若有64 g Cu被氧化,则被还原的HNO3的质量是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com