

| A. | 吗替麦考酚酯的分子式为C23H30O7N | |
| B. | 吗替麦考酚酯可发生加成、取代、消去反应 | |
| C. | 吗替麦考酚酯分子中所有碳原子一定处于同一平面 | |
| D. | 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应 |
分析 有机物含有酯基,可发生水解、取代反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有酚羟基,可发生取代、氧化反应,结合有机物的结构特点解答该题.
解答 解:A.由结构简式可知吗替麦考酚酯的分子式为C23H31O7N,故A错误;
B.羟基连接在苯环上,不能发生消去反应,故B错误;
C.含有饱和碳原子具有甲烷的结构特点,则所有碳原子不可能在同一个平面上,故C错误;
D.能与氢氧化钠反应的为酯基和酚羟基,含有2个酯基、1个酚羟基,则1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应,故D正确.
故选D.
点评 本题考查有机物结构和性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意分子式的确定,题目难度不大.


科目:高中化学 来源: 题型:推断题
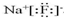 ,
, O2-
O2-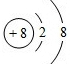 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
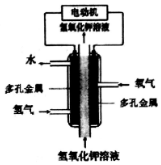
| A. | 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力 | |
| B. | 通H2的电极作负极,发生氧化反应 | |
| C. | 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O | |
| D. | 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶于水中:CO32-+2H2O?H2CO3+2OH- | |
| B. | 硫酸氢铵与少量氢氧化钠溶液混合共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 氯化铝溶液中滴入过量浓氨水:Al3++4NH3•H2O═A1O2-+4NH4++2H2O | |
| D. | 酸性高锰酸钾溶液与草酸溶液混合:5H2C2O4+6H++2MnO4-═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| B. | 32 g Cu和32 g S充分反应,转移的电子数为0.5NA | |
| C. | 1 mol Si中含有共价键数目为4NA | |
| D. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
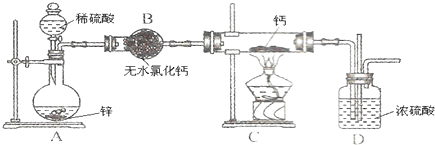
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
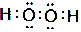 ;YW2分子形状为直线形.
;YW2分子形状为直线形.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com