

| A. | 装置①中阴极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中a为负极,发生的电极反应式为H2+2OH-+2e-═2H2O | |
| D. | 装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜 |
分析 A、电解时,溶液中铜离子得电子能力大于氢离子;
B、电镀时,镀件应与电源负极相连;
C、图中没有说明电解质溶液的酸碱性;
D、阳离子交换膜只允许阳离子通过.
解答 解:A、电解氯化铜溶液时,阴极上铜离子得电子析出金属铜单质,则阴极上析出红色固体,故A正确;
B、电镀时,镀层应与电源正极相连,镀件与电源负极相连,所以铜做阳极,待镀铁制品应与电源负极相连,故B正确;
C、图中没有说明电解质溶液的酸碱性,无法确定氢气在负极上失电子之后生成的是氢离子还谁,故C错误;
D、装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜,阳离子交换膜只允许阳离子通过,则钠离子通过阳离子交换膜进入阴极形成氢氧化钠,故D正确;
故选C.
点评 本题考查了原电池和电解池原理,难度不大,注意电解池中如果较活泼的金属作阳极,电解池工作时,阳极上金属失电子而不是溶液中阴离子失电子.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ②③⑤⑥⑦ | D. | ①②⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量 | B. | 密度 | C. | 分子总数 | D. | 质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
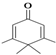 如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )
如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )| A. | Penguinone中存在两种官能团 | |
| B. | Penguinone是一种芳香醛 | |
| C. | Penguinone中存在与乙烯相同的官能团,所以其与乙烯有相似的性质 | |
| D. | 如果该分子中的双键都能加成,则1 mol Penguinone能与3 mol氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
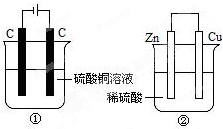 如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200ml,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线上都通过了0.02mole-,若不考虑溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积①=② | |
| B. | 溶液的pH变化:①减小②增大 | |
| C. | 电极上析出固体质量①<② | |
| D. | 电极反应式:①中阳极:Cu2++2e-═Cu②中负极Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、BaSO4、O2 | B. | FeCl2 溶液、Fe 粉、Cl2 | ||
| C. | H2O、CaCO3、SO3气体 | D. | H2O、SiO2、HCl 气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
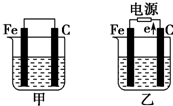 如图所示,甲、乙是电化学实验装置,请回答下列问题:
如图所示,甲、乙是电化学实验装置,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com