
【题目】设NA为阿伏加德罗常数的值。下列有关钠及其化合物叙述错误的是。
A. 标准状况下,2.24 L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.1NA个
B. 1molNa2O2与足量的水反应,转移的电子数为2NA个
C. 常温下,2.3g钠投入到100mL水中,钠失去的电子数为0.1NA
D. 0.1mol钠在空气中完全燃烧生成Na2O2,转移的电子数为0.1NA
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
【题目】高锰酸钾和浓盐酸可以发生下列反应:2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)用双线桥法表示此反应的电子转移的方向及数目_____________
(2)该反应的氧化剂是______,还原剂是________。HCl表现 ___________性和 ____性。
(3)若消耗0.2 mol氧化剂,转移电子的物质的量是________ mol。生成氯气在标准状况下的体积是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。
完成下列填空:
(1)碳原子的原子结构示意图是____________。氧原子核外能量不同的电子有_____种。CO2的电子式是_________________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。______________________
(3)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_______________。
证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+H2O→Na2SO4+H2SO4,该反应中,氧化产物是_____;若反应中转移了0.04 mol的电子,有____g Na2S2O5参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用下图装置制取并研究SO2的性质。
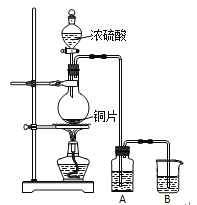
完成下列填空:
(1)圆底烧瓶中反应的化学方程式为_____________________________________。
(2)若A中盛放品红溶液,可以验证的SO2性质是______________。若要验证SO2的还原性,A中应盛放_________溶液。B中应盛放_________溶液。
II.为测定反应后的溶液中残留的硫酸浓度,实验小组进行如下探究。
(3)甲组:取1 mL反应液加水稀释至100 mL,再取10 mL稀释液与足量锌粒用下图装置进行测定。在读取反应前后量气管中液面读数时应先调节水准管与量气管中液面等高,这样操作的目的是________。
实验测得反应生成的氢气体积为22.4 mL(已换算到标准状况),计算原反应液中残留的硫酸浓度为______mol/L。

(4)乙组:欲通过加入足量的BaCl2溶液,测定生成的BaSO4沉淀质量来达到实验目的。该设计思路不可行,理由是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与应用不相对应的是
A. Na2CO3的水溶液呈碱性,医学上能用作治疗胃酸过多
B. Na2O2能分别与H2O、 CO2反应,可用作供氧剂
C. 生石灰吸水能力强,常用作袋装食品的干燥剂
D. 铝是活泼的金属单质,铝可用于冶炼某些熔点较高的金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取不同质量样品溶于水后分别逐滴加入相同浓度盐酸30 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积)与加入样品的质量关系如图所示(不考虑CO2在水中的溶解、反应)。请计算:

(1)样品中n(Na2CO3) : n(NaHCO3)=____________。
(2)盐酸的物质的量浓度c(HCl)=________mol·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )


A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com